« zurück zur Übersicht - Projektarbeiten
"Glauber und seine Chemie der Salze"
von Kathrin Meisberger (Schuljahr 2004/05)
| 1. Einleitung und Problemstellung | zum Seitenanfang  |
Das Thema der vorliegenden Projektarbeit ("Glauber und seine Chemie der Salze") entstand im Hinblick auf den 400-jährigen Geburtstag von Johann Rudolph Glauber, einem der bedeutendsten Chemiker seiner Zeit. Im Sinne der Problemstellung wird zunächst auf wichtige naturwissenschaftliche Gesichtspunkte des 16. und 17. Jahrhunderts eingegangen, um auf diesem Hintergrund das naturwissenschaftliche Handeln und Denken Glaubers verstehen und deuten zu können. Zudem werden einige von ihm durchgeführte Versuche im experimentellen Teil näher erläutert und im Hinblick auf heutige Deutungen erörtert und diskutiert.
Ziel der Projektarbeit ist es demnach, einige Versuche Glaubers nachzuvollziehen und mit den vorhandenen Mitteln nachzustellen sowie Schlussfolgerungen aus den erzielten Ergebnissen zu ziehen. Glauber, der in einigen Gebieten der Chemie Pionierarbeit geleistet hat, standen keine literaturgemäßen Angaben zur Verfügung, sodass auch im Verlauf der Projektarbeit vordergründig auf konkrete Arbeitsvorschriften als Vorlage zur Versuchsdurchführung verzichtet wurde. Vielmehr sollten durch konkretes "Probieren" Ergebnisse erzielt bzw. erfolglose Untersuchungen gedeutet werden. Ein solches Vorgehen wird der methodischen Vorgehensweise Glaubers näher kommen als die Verwendung "moderner" Analysenvorschriften.
Als Hilfsmittel stand mir die Kopie einer Dissertation [1] zur Verfügung, da die Originalliteratur von Johann Rudolph Glauber allein aufgrund der alchemistischen Darstellungsweise in ihrer Interpretation sehr aufwändig gewesen wäre. Grundgerüst für die Durchführung der Projektarbeit war somit eine Analyse der mir vorliegenden Doktorarbeit, die einen entsprechenden Rahmen für die methodische Vorgehensweise lieferte.
| 2. Theoretischer Teil | zum Seitenanfang  |
| 2-1. Allgemeines zur Chemie im 16. und 17. Jahrhundert | zum Seitenanfang  |
Der Schwerpunkt der chemischen Forschung des 16. und 17. Jahrhunderts lag im Bereich der Salze. Im Gegensatz zur Chemie des Mittelalters, die sich auf sulfidische Verbindungen beschränkte, nahmen zur Zeit Glaubers die Metalle eine Schlüsselposition ein. Die damalige Nomenklatur war stark von alchemistischen Begriffen und Denkweisen geprägt, obwohl sich einige Wissenschaftler schon weitgehend von der Zielsetzung der Alchemisten entfernt hatten. Die enge Verknüpfung von Naturwissenschaft, Astronomie und Religion während dieser Zeit spiegelt sich unter anderem in der Namensgebung der Metalle wider. Als die 7 wichtigsten Metalle der Alchemisten werden (in heutiger Nomenklatur) Blei, Eisen, Gold, Kupfer, Quecksilber, Silber und Zinn genannt. Ihre alchemistischen Bezeichnungen blieben auch zu Glaubers Zeit aktuell. [2]
| Element | alchemistische Nomenklatur |
| Blei | Saturn |
| Eisen | Mars |
| Gold | Sonne (Sol) |
| Kupfer | Venus |
| Quecksilber | Mercur/Mercurius |
| Silber | Mond (Luna) |
| Zinn | Jupiter |
Tabelle 1: Die wichtigsten Metalle und ihre Benennung nach alchemistischer Nomenklatur[3]
Die Bezeichnung weiterer damals bekannter Verbindungen folgt einer lateinischen Nomenklatur, wobei viele Begrifflichkeiten aus dem alltäglichen Gebrauch stammen und von den charakteristischen Eigenschaften der entsprechenden Substanz abgeleitet sind. Konzentrierte Säuren glichen in ihrer Konsistenz dem Öl, das man sowohl aus dem häuslichen als auch medizinischen Gebrauch kannte. Man benannte sie als "Oleum", dem lateinischen Begriff für Öl. Beobachtete man beim Erhitzen einer Substanz eine Rauch- oder Nebelbildung, so sprach man von "Spiritus" (lat.: Geist). In diesem Begriff spiegelt sich die religiöse Seite der Alchemie wider. Angedeutet wird vermutlich das Aufsteigen des menschlichen Geistes im spirituellen Sinne.
| alchemistische Nomenklatur | Verbindung |
| Oleum | (lat.: Öl) im Zusammenhang mit Säure oder Lösung gebraucht, zurückzuführen auf die hohe Viskosität konzentrierter Säuren |
| Vitriolum | (lat:. Vitriol) wasserhaltiges Sulfat |
| Flores | (lat: Blume, Blüte) Oxide |
| Spiritus | (lat.: Geist), sowohl in der Übersetzung "Lösung" als auch "Dampf" gebraucht; bezeichnet Säuren oder Laugen, die man durch Lösen des entsprechenden Dampfes in Wasser gewonnen hat. |
Tabelle 2: wichtige Substanzgruppen und Benennung nach alchemistischer Nomenklatur [4]
Die Benennung spezifischer Verbindungen (z. B. Eisenoxid) erfolgt durch Nennung der Obergruppe (in diesem Fall Flores = Oxide) und dem lateinischen Genitiv des entsprechenden Metalls (in diesem Fall Mars = Eisen, Genitiv: Martis). Eisenoxid wurde folglich als "Flores Martis" bezeichnet. Bei "Vitriolum" und "Spiritus" wird die gleiche Verfahrensweise angewandt. Unter dem Begriff "Spiritus urinae" (lat.: Uringeist) verstand man damals Ammoniaklösung, Schwefelsäure wurde als "Oleum Vitrioli" bezeichnet. [4]
Die Alchemisten bemühten sich ebenfalls um eine Erklärung oder Deutung der beobachteten Reaktionen, die sie auf die 4-Elemente-Theorie stützten. Man dachte sich alle Stoffe aus einer bestimmten Kombination der 4 Elemente Wasser (aqua), Feuer (ignis), Luft (aer) und Erde (terra) zusammengesetzt [6]. Erweitert wurde diese Theorie durch Paracelsus, der von der 'tria prima' sprach. Quecksilber, Schwefel und Salz seien die 3 Prinzipien, in denen sich die Elemente manifestierten und aus denen alle irdischen Dinge bestehen. Eine ablaufende Reaktion wurde als Änderung in der substanzeigenen Zusammensetzung bezüglich der Elemente bzw. Prinzipien gedeutet. Oft wurden Analogien zu biologischen Prozessen verwendet, um chemische Prozesse zu beschreiben. Wie bei den späteren Chemikern fand diese Deutungsweise unter anderem auch bei Glauber Anwendung. [7]
Die Definition des Salzes an sich war noch unbestimmt, man verstand jedoch darunter alle festen wasserlöslichen Stoffe. In der Elemententheorie steht das Salz für Wasserlöslichkeit und den salzigen Geschmack. [5]
| 2-2. Lebenslauf von Johann Rudolph Glauber | zum Seitenanfang  |
Johann Rudolph Glauber wurde 1604 als Sohn eines Barbiers in Karlstadt geboren. Nach unvollendeter Schulausbildung arbeitete er in verschiedenen Apotheken und war schließlich als Chemiker und Technologe tätig. Aufgewachsen zur Zeit des Dreißigjährigen Krieges (1618 - 1648), zwangen ihn die Auseinandersetzungen zu einem ständigen Wechsel des Wohnortes. So gelangte er unter anderem nach Wien und war einige Jahre als Spiegelmacher auf Reisen. Er besuchte die Städte Salzburg, Basel, Paris, Straßburg und Frankfurt am Main und zog schließlich nach Amsterdam, wo er sein erstes eigenes Labor eröffnete und sich mit der gewerblichen Herstellung chemischer Stoffe beschäftigte. Nach weiteren Aufenthalten in Wertheim, Kitzingen und Frankfurt am Main siedelte er 1656 endgültig nach Amsterdam über. [8]
Er starb dort 1670 nach langwieriger Krankheit (wahrscheinlich an einer chronischen Vergiftung, verursacht durch die jahrlange Arbeit mit gesundheitsschädlichen Chemikalien). Trotz allem wird Glauber als erster Chemiker benannt, der vom Verkauf der in seinem Laboratorium hergestellten Proben leben konnte. [9]
| 2-3. Glaubers chemische Arbeit | zum Seitenanfang  |
Glaubers Forschung im chemischen Bereich war sehr stark von alchemistischem Gedankengut geprägt. Bemerkenswert ist, dass seine Schriften ausschließlich auf Deutsch verfasst sind - eine Tatsache, die ihn von allen anderen Naturwissenschaftlern seiner Zeit abhebt. Üblich war die Verwendung von Latein, der Sprache der Gelehrten. Glauber jedoch, der keine vollständige Schulausbildung vorzuweisen hatte, war dieser Sprache nicht - bzw. nur unzureichend - mächtig. Aus Gründen der Verständlichkeit behielt er jedoch die damals übliche lateinische Nomenklatur bei.
Das Spektrum der Arbeitsbereiche von Glauber erstreckt sich von chemischen Synthesen bis hin zur Entwicklung von Arzneimitteln. So beschäftigte er sich mit der Ausarbeitung verschiedener Verfahren zur Herstellung von Mineralsäuren und Salzen, mit der trockenen Holzdestillation, der Glasfärbetechnik, der Verbesserung zur Herstellung von Wein und Bier und der Entwicklung von Medikamenten auf der Basis von Antimon. Zudem entwickelte er Öfen für sehr unterschiedliche Anwendungen, zum Beispiel für die Destillation und zur Gewinnung von Sublimaten und Oxiden. Er war der erste, der den Einsatz chemischer Stoffe in der Pharmazie propagierte und leitet somit eine neue Richtung innerhalb der Arzneimittelforschung ein. [10]
2.3.1. Glaubers Mineralsäuren
Salzsäure, Salpetersäure und Schwefelsäure gehören zu den wichtigsten Mineralsäuren, die von Glauber synthetisiert wurden. Auch kannte er verschiedene Techniken, mit deren Hilfe er die 'acidi' gewinnen konnte (s. Tabelle 3) und bemerkte richtig, dass die Eigenschaften der Säure unabhängig vom Herstellungsverfahren stets die gleichen blieben. [11]
Die Verwendung von Salzsäure und Schwefelsäure war im 17. Jahrhundert schon weit verbreitet, Glauber war jedoch der erste, der sie in gewerblichem Maßstab produzierte. Er revolutionierte die Salzsäureherstellung, indem er von Natriumchlorid und Schwefelsäure ausging. Salpetersäure wurde erstmals von Glauber mittels Trockendestillation hergestellt. [12]

2.3.2. Glaubers Salze
Glauber verfasste zahlreiche Schriften (z. B. "Tractatus de natura salium", zu Deutsch "Abhandlung über die Natur des Salzes"), in denen er den Salzen neben den Säuren besondere Zuwendung schenkt. Er stellt darin die wichtigsten Salze mit ihren Eigenschaften und Reaktionsweisen vor. Besondere Erwähnung finden: Alaun, Kochsalz, Salmiak, Salpeter, Vitriol und die "fixen Salien" wie Natrium- und Kaliumcarbonat, die er für seine Produktion nutzte (Tabelle 4). Daneben kannte man eine Vielzahl salzartiger Verbindungen, die Glauber entweder selbst herstellte oder für seine Synthesen verwendete [13] (Tabelle 5).
Als bedeutendstes Salz nennt er Natriumchlorid, das aus der Sonne entstanden sei und durch Feuer oder andere Zusätze verändert werden könne. Alles auf der Welt gehe aus einem einzigen Ursprung hervor und so müssten auch alle Salze aus dem einen Salz hervorgehen. Glauber erwähnt die 'Umkehrung des Salzes' und stellt in diesem Zusammenhang die Behauptung auf, Salpeter könne beispielsweise aus Natriumchlorid gewonnen werden. Obwohl diese These heute als falsch zu beurteilen ist, erkannte Glauber richtig, dass die Eigenschaften des Salpeters (und allgemein der Salze) von Herstellungsverfahren unabhängig sind und stets gleich bleiben [14].
Glauber synthetisierte eine Reihe von Salzen (s. Tabelle 6) für ganz unterschiedliche Zwecke. Grundvoraussetzung seiner Überlegungen war unter anderem die Gegenüberstellung von Säuren und Laugen, die in gewissem Sinne als Gegensätze zu betrachten sind. Zusammengefügt ergeben sie ein Salz, in dem sowohl ein alkalischer als auch ein saurer Anteil enthalten sind. [9]
Ausgehend von dieser Überlegung stellte er Ammoniumchlorid aus Salzsäure und Ammoniak her. Die Metallchloride gewann er durch Auflösen des entsprechenden Metalls oder Metalloxids in Salzsäure. Er nahm damit Abstand von der bis dahin üblichen Darstellung durch Sublimation mit Quecksilberchlorid. Auf diese Weise gewann Glauber Silberchlorid, Kupferchlorid, Bleichlorid, Arsen(III)chlorid, Antimon(III)-chlorid ('Butyrum Antimonii') und Zinkchlorid.
Die Sulfate nehmen ebenfalls einen breiten Raum in Glaubers Arbeit ein und wurden ähnlich wie die Chloride aus Schwefelsäure und dem entsprechenden Metall (oder Metalloxid) gewonnen. Größte Popularität brachte ihm sein 'Sal mirabile Glauberi', das Natriumsulfat, ein. Daneben stellte er das Vitriolum Martis et Veneris' (Eisen- und Kupfersulfat), das 'weiße Vitriol' oder 'Vitriolum vomitivum' (Zinksulfat) her und gewann zudem das 'Sal Armoniacum Secretum' (Ammoniumsulfat) aus 'Oleum Vitrioli' und 'Spiritus urinae'. Das 'nitrum Vitriolatum' (Kaliumsulfat) blieb als Rückstand bei der Destillation von Salpetersäure.
Glauber verallgemeinerte, dass man alle "Flores" ausgehend von ihrem Metall herstellen könne. Hierzu musste das entsprechende Erz in einem speziellen Ofen, in dem sehr hohe Temperaturen erreicht werden konnten, direkt auf glühende Kohlen gegeben werden. Diese Vorgehensweise stellte eine wichtige Erneuerung im Bereich der Salzgewinnung dar. Üblich war die Synthese der Oxide durch Fällung. [13]

| Heutige Nomenklatur | chemische Formel | damalige Bezeichnung |
| Ammoniumsulfat | (NH4)2SO4 | Sal Armoniacum Secretum |
| Antimonchlorid | SbCl3 | Butyrum Antimonii, Oleum Antimonii, Spießglanzbutter |
| Antimontrioxid | Sb2O3 | |
| Antimontrisulfid | Sb2S3 | Grauspießglanz |
| Arsensulfid | As4S4 | rotes Arsenicum, Realgar |
| Arsentrichlorid | AsCl3 | |
| Arsentrioxid | As2O3 | weißes Arsenicum |
| gelbes Arsensulfid | As2S3 | gelbes Arsenicum, Operment, Auripigment |
| Bleichlorid | PbCl2 | |
| Bleinitrat | Pb(NO3)2 | Crystallum Saturni |
| Bleioxid | PbO | Flores Saturni |
| Eisenoxid | FeO | Flores Martis |
| Goldoxid | Au2O3 | |
| Kaliumsulfat | K2SO4 | Nitrum vitriolatum, Salz polychrestum |
| Kupfer(II)chlorid | CuCl2 | |
| Kupfersulfat | CuSO4 | Vitriolum Veneris |
| Kupferoxid | CuO | Flores Veneris |
| Natriumsulfat | Na2SO4 | Sal mirabile (Glauberi) |
| Quecksilber(II)oxid (Zinnober) | HgO | Flores Mercurii |
| Quecksilberchlorid | HgCl2 | Quecksilbersublimat |
| Silberchlorid | AgCl | Argentum cornu |
| Silberoxid | Ag2O | |
| Silbernitrat | AgNO3 | |
| Zinkchlorid | ZnCl2 | Zinkbutter |
| Zinkcarbonat (Zinkspat) | ZnCO3 | Galmei |
| Zinkoxid | ZnO | |
| Zinksulfat | ZnSO4 | weißes Vitriolum, Vitriolum Vomitivum |
| Zinnnitrat | SnNO3 | Crystallum Jovis |
| Zinnoxid | SnO | Flores Jovis |
Tabelle 5: Die zur Zeit Glaubers bekannten Salze

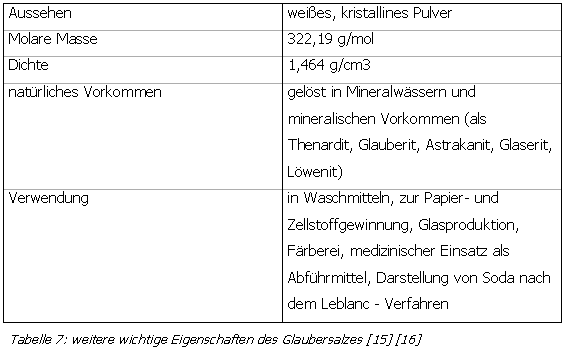
| 2-4. Glaubersalz (Natriumsulfatdecahydrat Na2SO4 • 10 H2O) | zum Seitenanfang  |
Benannt nach seinem "Erfinder" nimmt das Glaubersalz (auch: "sal mirabile Glauberi") eine wichtige Stellung in der Arbeit Glaubers ein. Das von ihm um 1655 erfundene Verfahren basiert auf dem Einsatz von Natriumchlorid und Schwefelsäure, bei dem neben Natriumsulfat auch Salzsäure entsteht. Heute besitzt diese Darstellungsform praktisch keine Bedeutung mehr. Vielmehr fällt Natriumsulfat in großen Mengen als Nebenprodukt bei der Gewinnung von Natriumchlorid, Soda, Borax, Lithium- und Kaliumsalzen und bei chemischen und metallurgischen Prozessen zur Herstellung von Natriumdichromat, Vitamin C und Viskosefasern an. Glaubersalz ist sehr gut wässerlöslich, wobei bei 32,38 °C ein Maximum erreicht wird (es lösen sich bei dieser Temperatur 322,67 g Natriumsulfatdecahydrat in 100 g Wasser). Die Lösungen reagieren neutral. Unterhalb von 32 °C kristallisieren große, farblose, monokline Prismen aus, die an Luft zu einem weißen, kreideartigen Pulver unter Kristallwasserverlust verwittern. Beim Erwärmen auf 33 °C erhält man kristallwasserfreies Natriumsulfat, das rhombisch bipyramidal auskristallisiert und sich in Wasser im Gegensatz zum Deacahydrat unter Erwärmung löst. [15] [16]
| 2-5. Schlussfolgerungen aus seiner Arbeit | zum Seitenanfang  |
Durch seine kontinuierliche Forschung mit Metallen, Säuren und Salzen erkannte Glauber das spezifische Lösungsverhalten der Metalle, das zur Trennung eines Gemisches genutzt werden kann und das Bestandteil seiner Affinitätsstudie war. Während sich Silber, Zinn und Blei in Salpetersäure lösen, kann man Eisen und Kupfer nur in wässriger Schwefelsäure in Lösung bringen. Glauber stellte die Behauptung auf, kein Metall sei löslicher als Zink (`Zink liebe die Säuren und werde von ihnen geliebt`) und bezeichnete den "Spiritus nitri" (Salpetersäure) als Universallösemittel. [17]
| 3. Experimenteller Teil | zum Seitenanfang  |
| 3-1. Einleitung | zum Seitenanfang  |
Folgende Versuche wurden im Sinne des experimentelles Teils der Projektarbeit durchgeführt, protokolliert und diskutiert:
- Darstellung von Silberchlorid (AgCl) und Bleichlorid (PbCl2) mittels Fällungsreaktion (s. Anhang S. V Bild 1 und 2)
- Darstellung und Auskristallisieren von Glaubersalz (Na2SO4 • 10 H2O) (s. Anhang S. V-VI, Bild 3,4 und 5)
- Darstellung von Ammoniumchlorid (NH4Cl) und Aufzeigen des Phänomens der Sublimation (s. Anhang S. VI Bild 6)
- Versuch der Darstellung von Kupfer(II)chlorid (CuCl2) aus Kupferoxid (CuO) und elementarem Kupfer (Cu) (s. Anhang S. VI-VII Bild 7-9)
- Untersuchung des spezifischen Lösungsverhaltens der Metalle am Beispiel Eisen (Fe), Kupfer (Cu) und Zink (Zn) (s. Anhang S. VII-VIII Bild 11-13)
- Darstellung von Salpetersäure (HNO3) mittels Trockendestillation (s. Anhang S. VIII-IX Bild 14-17)

| 3-2. Darstellung von Silberchlorid (AgCl) und Bleichlorid (PbCl2) | zum Seitenanfang  |
3.2.1. Reaktionsgleichungen
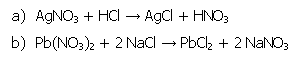
3.2.2. Versuchsdurchführung
-
Fällung von Silberchlorid
verwendete Geräte:
- 2 Bechergläser 600 mL
- Glasstab
- Weißbandfilter
- Schnelllauftrichter
- Teklubrenner, Drahtnetz, Keramikplatte, Dreifuß
verwendete Chemikalien:
- Silbernitratlösung [c(AgNO3) = 0,01 mol/L]
- verdünnte Salzsäure [c(HCl) ~ 0,2 mol/L]
Ca. 100 mL Silbernitratlösung [c(AgNO3) = 0,01 mol/L] werden in der Siedehitze so lange unter Rühren mit verdünnter Salzsäure [c(HCl) ~ 0,2 mol/L] versetzt bis kein Niederschlag mehr entsteht, das heißt, bis an der Eintropfstelle keine Trübung mehr auftritt. Anschließend wird durch Weißbandfilter abfiltriert, wobei die Probe möglichst vor Licht geschützt werden sollte, da ansonsten sofort eine chemische Zersetzung von Silberchlorid in die Elemente einsetzen würde. Der Niederschlag wird getrocknet und anschließend im Dunkeln aufbewahrt.
-
Fällung von Bleichlorid:
verwendete Geräte:
- Becherglas 150 mL
- Schnelllauftrichter
- Weißbandfilter
verwendete Chemikalien
- Bleinitrat (Pb(NO3)2) (reinst)
- Natriumchloridlösung [w(NaCl) = 0,1]: 10 g Natriumchlorid (reinst) werden in der Wärme in 100 mL demineralisiertem Wasser gelöst
10 g Bleinitrat [Pb(NO3)2] werden in einem 150 mL Becherglas in 50 mL demineralisiertem Wasser gelöst und mit 10 % iger Natriumchloridlösung [w(NaCl) = 0,1] solange versetzt bis kein Niederschlag mehr ausfällt, das heißt, bis an der Eintropfstelle keine Trübung mehr auftritt. Der Niederschlag wird durch Weißbandfilter filtriert und getrocknet (s. Bild 2).
3.2.3. Beobachtungen
Eine Niederschlagsbildung ist unmittelbar beim Eintropfen der Fällungsreagenz sichtbar (s. Anhang S. V Bild 1). Die Eigenschaften des Niederschlages variieren je nach Temperatur, Verdünnung des Fällungsmittels und der Ausgangslösung sowie nach Schnelligkeit der Fällung.
3.2.4. Beobachtung und Schlussfolgerung Glaubers
Glauber erkannte, dass bei Zugabe von Natriumchloridlösung zu einer Lösung von Silbernitrat ein Niederschlag ausfällt, der sich leicht schmelzen ließ und in Ammoniak löslich war [18]. Der neu entstandene Stoff unterschied sich in seinen Eigenschaften von denen der Ausgangsprodukte. Er schloss daraus, dass auch die stoffeigene Zusammensetzung von der der Edukte verschieden sein musste. In gleicher Weise verhält es sich mit Bleichlorid, das er ebenfalls durch Fällung darstellte.
3.2.5. Erklärung heute
Die Schwerlöslichkeit eines Salzes wird heute als Grundlage für die Deutung einer Fällungsreaktion definiert. Tabellarisch erfasst ist sie im so genannten Löslichkeitsprodukt, das sich aus folgender Formel ergibt:

Für Silberchlorid ergibt sich ein Löslichkeitsprodukt von 1,1 • 10-10 mol2/L2. Wird das Löslichkeitsprodukt überschritten (d.h. c(Ag+) • c(Cl-) > 1,1 • 10-10 mol2/L2), so bildet sich eine übersättigte Lösung, die thermodynamisch instabil ist. Es fällt so lange festes Silberchlorid aus, bis die Gleichung wieder erfüllt ist (das heißt, bis wieder ein Gleichgewicht hergestellt ist und kein Ionenaustausch mehr stattfinden muss). Ist das Produkt der Konzentrationen jedoch geringer als das Löslichkeitsprodukt, so liegt keine gesättigte Lösung vor, der Bodenkörper fehlt.
Auch die Niederschlagsbildung bei Bleichlorid kann als Folge der Überschreitung des Löslichkeitsproduktes (L = 1,7 • 10-5 mol3/L3) gedeutet werden. [19]
| 3-3. Darstellung und Auskristallisieren von Glaubersalz | zum Seitenanfang  |
3.3.1. Reaktionsgleichung
![]()
3.3.2. Versuchsdurchführung
verwendete Geräte:
- Becherglas 600 mL
- 2 Bechergläser 150 mL
- 2 Erlenmeyerkolben 300 mL
- Teklubrenner, Drahtnetz, Dreifuß, Keramikplatte
- Laborthermometer
- Wasserbad
- Watte
verwendete Chemikalien:
- Natriumchlorid (NaCl) reinst
- verdünnte Schwefelsäure [c(1/2 H2SO4) ~ 2 mol/L]
- Natriumsulfat wasserfrei (Na2SO4) (reinst)
- Natriumsulfatdecahydrat (Na2SO4 • 10 H2O) (reinst)
Zur Darstellung von Glaubersalz (Na2SO4 • 10 H2O) werden ca. 20 g Natriumchlorid in 150 ml verdünnter Schwefelsäure [c(1/2 H2SO4) = 2 mol/L] in der Wärme gelöst. Die Lösung wird auf ca. 75 mL eingedampft und zum Auskristallisieren an einem kühlen Ort möglichst erschütterungsfrei aufbewahrt.
Zum Auskristallisieren von Glaubersalz werden a) je 32,3 g wasserfreies Natriumsulfat bzw. b) Natriumsulfatdecahydrat in 2 separaten 150 mL Bechergläser mit 10 mL demineralisiertem Wasser versetzt. Es wird vorsichtig im Wasserbad auf 33 °C erwärmt bis alles gelöst ist. Sollte nicht alles in Lösung gehen, so muss wenig demineralisiertes Wasser zugefügt werden, eine Erwärmung über 33 °C ist zu vermeiden. Die klare Lösung wird anschließend (erschütterungsfrei) auf Raumtemperatur abgekühlt und mit einem Kristall von Natriumsulfatdecahydrat (Na2SO4) angeimpft.
3.3.3. Beobachtungen
Glaubersalz kristallisiert als große, farblose, monokline Prismen aus, die an der Luft unter Kristallwasserverlust verwittern. (s. Bild 3)
-
Arbeiten mit wasserfreiem Natriumsulfat (Na2SO4)
Bei 33 °C entsteht eine klare Lösung, die beim Abkühlen auf Raumtemperatur zunächst nicht auskristallisiert. Erst nach längerem Ruhen der Lösung bilden sich Kristalle bis schließlich eine eisartige Masse aus Glaubersalzkristallen entstanden ist. Das Animpfen mit einem Kristall bewirkt weder vor noch nach dem Auskristallisieren eine Veränderung.
-
Arbeiten mit Natriumsulfatdecahydrat (Na2SO4 • 10 H2O)
Die bei 33 °C entstandene klare Lösung kristallisiert auch bei längerem Stehen lassen nicht aus (s. Bild 4). Erst durch das Animpfen mit einem Kristall setzt eine schlagartige Kristallbildung ein bis eine eisartige Masse entstanden ist (s. Bild 5).
Bemerkung:
Bei 5 voneinander unabhängigen Versuchsdurchführungen zu Teil b) sind nur bei 2 oben genannte Beobachtungen aufgetreten. In den übrigen Fällen setzte schon beim Abkühlen die Kristallbildung ein, das Animpfen mit einem Kristall hatte keinen Einfluss. Vermutlich war das verwendete Glaubersalz verunreinigt, sodass die Kristallisation durch Staubpartikel oder Kontaminationen gefördert wurde.
Anhand einer konkreten Arbeitsvorschrift wurde der Versuch folgendermaßen modifiziert:
30 g Glaubersalz werden in einem Erlenmeyerkolben in 12 - 15 mL Wasser bei 40 - 50 °C vollständig gelöst. Die warme Lösung wird anschließend filtriert und in einem 2. Erlenmeyerkolben aufgefangen. Mit Watte wird das Gefäß verschlossen und bis zum Sieden erhitzt bis Dampf durch die Watte dringt. Sollten an dieser Stelle Kristalle entstehen, so muss erneut filtriert werden. Nach dem Abkühlen auf ca. 20 °C wird mit einem Kristall aus Natriumsulfatdecahydrat angeimpft. [20]
Ergebnis:
Mit der modifizierte Fassung der Versuchsdurchführung funktionierte die Auskristallisation zuverlässiger. Die übersättigte Lösung reagiert jedoch äußerst empfindlich auf Bewegung und kristallisiert auch bei kleinen Erschütterungen von selbst aus.
3.3.4. Beobachtung und Schlussfolgerung Glaubers
Durch das Einwirken von "Oleum Vitrioli" auf Kochsalz entstand ein neuer Stoff, den Glauber durch Eindampfen gewinnen konnte und der in großen platten Kristallen auskristallisierte. Sein 'sal mirabile' ließ sich unter anderem als Arzneimittel einsetzen.
3.3.5. Erklärung heute
Natriumsulfatdecahydrat (Na2SO4 • 10 H2O) erreicht bei genau 33 °C seine maximale Löslichkeit in Wasser, wobei 100 Teile Wasser 322,67 Teile Glaubersalz lösen. Kühlt man die so entstandene Lösung auf Raumtemperatur ab, so treten Übersättigungserscheinungen auf. Es hat sich ein Natriumsalz mit weniger Kristallwassern gebildet, das erst durch das Animpfen mit einem Kristall als Natriumsulfatdecahydrat auskristallisiert. [21]
Die modifizierte Fassung des Experiments hat den Vorteil, dass eventuell vorhandene Verunreinigungen durch das Abfiltrieren beseitigt werden. Welchen Einfluss das erneute Erhitzen nach dem Verschließen des Gefäßes mit Watte hatte, konnte ich nicht eindeutig klären. Das Auflösen von Glaubersalz wurde bei 40-50 °C durchgeführt, sodass die Temperatur maximaler Löslichkeit (33 °C) überschritten wurde. Vermutlich wird durch das Erwärmen (unter Verschluss mit Watte) eine hinreichend große Menge des Lösungsmittels in Form von Wasserdampf beseitigt. Auf diese Weise wird sichergestellt, dass auch tatsächlich eine übersättigte Lösung entsteht. Es könnte sich hierbei um einen Erfahrungswert handeln; das Experiment funktionierte auf diese Weise jedoch besser. Die Watte sorgt dafür, dass während des Abkühlungsprozesses keine Störpartikel in die Lösung gelangen und kein Wasserdampf entweicht.
Arbeitet man mit wasserfreiem Natriumsulfat, so gelingt das Experiment nicht, da die maximal lösliche Menge nicht ausreicht um eine übersättigte Lösung zu erzeugen.
| 3-4. Darstellung von Ammoniumchorid (NH4Cl) und das Phänomen der Sublimation | zum Seitenanfang  |
3.4.1. Reaktionsgleichungen
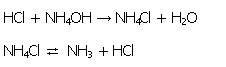
3.4.2. Versuchsdurchführung
verwendete Geräte
- 2 Bechergläser (150 mL)
verwendete Chemikalien
- konzentrierte Salzsäure [c(HCl) = 10 mol/L]
- konzentrierter Ammoniak [c(NH4OH) = 10 mol/L]
2 Bechergläser (150 mL) werden mit etwa gleicher Menge an konzentrierter Salzsäure bzw. konzentriertem Ammoniak befüllt. Beide Gefäße werden im Abzug so nebeneinander gehalten, dass die aufsteigenden Dämpfe miteinander reagieren können.
3.4.3. Beobachtung
Es steigt ein weißer Rauch von Ammonchlorid auf, ohne dass die Flüssigkeiten direkt miteinander in Kontakt gekommen sind (s. Bild 6).
3.4.4. Bemerkung
Führt man die Reaktion wie unten beschrieben in einem Gefäß durch, so scheidet sich das weiße Ammoniumchlorid als Salz ab.
Erhitzt man festes Ammoniumchlorid vorsichtig in einem Reagenzglas, so ist ebenfalls eine Rauchbildung erkennbar, ohne dass eine Schmelze als intermediärer Zustand entsteht.
3.4.5. Beobachtung und Schlussfolgerung Glaubers
Die Entstehung von Ammoniumchlorid aus Ammoniak und Salzsäure deutet Glauber folgendermaßen: "wenn man einen 'Spirius Salis' zu 'Spiritus urinae' gieße, 'töteten' sie einander, verlören ihre Eigenschaft und bildeten ein Salz". [22]
Auch das Phänomen der Sublimation war ihm geläufig. Erhitze man bestimmte Feststoffe oder eine Mischung aus ihnen, so schmelzen sie nicht - vielmehr gehe ein "spiritus" über.
3.4.6. Erklärung heute
In der Oberfläche fester Stoffe haben einige Moleküle genügend Energie, um aus dem Festkörper auszutreten. Ist der Dampfdruck eines festen Körpers gleich dem äußeren Druck, so geht der Körper bei entsprechender Temperatur in den gasförmigen Zustand übersublimiert. [23]
Erhitzt man Ammoniumchlorid, so scheint es zu sublimieren, obwohl diese Eigenschaft nur molekular aufgebaute Stoffe besitzen. Bei genauerer Untersuchung der Reaktion stellt man fest, dass es sich um eine Scheinsublimation handelt: Ammoniumchlorid zerfällt beim Erhitzen in Ammoniak und Chlorwasserstoff und bildet sich in kühleren Regionen aus diesen Produkten neu. [24]
| 3-5. Darstellung von Kupfer(II)chlorid (CuCl2) aus elementarem Kupfer (Cu) und Kupferoxid (CuO) | zum Seitenanfang  |
3.5.1. Reaktionsgleichungen
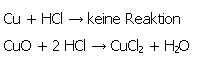
3.5.2. Versuchsdurchführung
verwendete Geräte
- 2 Reagenzgläser
- 1 Becherglas (600 mL)
- Teklubrenner, Drahtnetz, Dreifuß, Keramikplatte
- Glasstab
- Reagenzglasklammer
- Weißbandfilter
- Schnelllauftrichter
verwendete Chemikalien
- elementares Kupfer (Cu) reinst
- Kupferoxid (CuO) reinst
- verdünnte Salzsäure [c(HCl) ~ 2 mol/L]
Wenig elementares Kupfer bzw. Kupferoxid werden jeweils in ein Reagenzglas gegeben und mit verdünnter Salzsäure versetzt.
3.5.3. Beobachtung
Kupferoxid löst sich in der Kälte unter Bildung einer grünen Lösung von Kupfer(II)chlorid (s. Bild 7). Elementares Kupfer löst sich auch in der Wärme nicht (s. Bild 8).
3.5.4. Schlussfolgerung
Die Darstellung von Kupfer(II)chlorid kann nur aus Kupferoxid nach folgender Vorschrift erfolgen:
4 g Kupferoxid (CuO) werden in einem 600 mL Becherglas mit 50 mL verdünnter Salzsäure [c(HCl) ~ 2 mol/L] versetzt und auf ca. 30 mL eingedampft. Die Lösung wird anschließend abgekühlt und nach dem Auskristallisieren durch Weißbandfilter filtriert (s. Bild 10).
3.5.5. Beobachtung und Schlussfolgerung Glaubers
Glauber hatte bereits richtig erkannt, dass Kupfer in Salzsäure nicht gelöst werden kann. [25]
Seiner Meinung nach habe Kupfer eine geringe Affinität zur Säure, Kupferoxid dagegen eine relativ hohe, sodass man Kupfer(II)chlorid durch Lösen in Salzsäure nicht aus dem Element, sondern nur aus dem Oxid darstellen kann.
3.5.6. Erklärung heute
Kupfer als edles Metall löst sich nur in oxidierenden Säuren, allerdings nicht in verdünnter Salzsäure (vgl. E0 = +0,337 V, Erklärung s. 3.6.5).
| 3-6. Untersuchung des spezifischen Lösungsverhaltens am Beispiel von Kupfer, Eisen und Zink | zum Seitenanfang  |
3.6.1. Reaktionsgleichungen
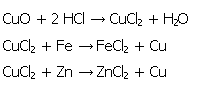
3.6.2. Versuchsdurchführung
verwendete Geräte
- 3 Bechergläser (150 mL)
- 3 Glasstäbe
- Teklubrenner, Drahtnetz, Dreifuß, Keramikplatte
- Weißbandfilter
- 1 Schnelllauftrichter
verwendete Chemikalien
- Kupferoxid (CuO) reinst
- Eisenpulver (Fe) reinst
- Zinkpulver (Zn) reinst
- verdünnte Salzsäure [c(HCL) ~ 2 mol/L]
- 1 Eisennagel
Je 1,0 g Kupferoxid werden in 3 Bechergläser (150 mL) gegeben und in der Wärme in verdünnter Salzsäure [c(HCL) ~ 2 mol/L] gelöst. Mit demineralisiertem Wasser wird anschließend auf 100 mL verdünnt und die Lösung in der Wärme mit 2 - 3 Spatelspitzen Eisen- bzw. Zinkpulver bzw. einem Eisennagel versetzt.
3.6.3. Beobachtung
Gibt man Kupferoxid zu verdünnter Salzsäure, so färbt sich die Lösung je nach Verdünnung blau bis grün (s. Bild 10). Unmittelbar nach der Zugabe von elementarem Eisen bzw. Zink entsteht rotes Kupfer, das schwammig anfällt und zunächst an der Oberfläche der Lösung schwimmt. Die ehemals grüne Lösung von Kupfer(II)-chlorid entfärbt sich zusehends (s. Bild 11). Der Eisennagel überzieht sich zunächst mit einer Schicht aus elementarem Kupfer, bis schließlich nur noch Kupfer vorliegt, das die Form des Nagels angenommen hat (s. Bild 12).
3.6.4. Beobachtung und Schlussfolgerung Glaubers
Glauber bezeichnete Zink als das löslichste Metall, das andere Metalle aus ihren Lösungen "vertreibe", da es selbst eine sehr hohe Affinität (= Gemeinschaft) zu Säuren habe. Gebe man also Zink zu einer Lösung aus Kupfer(II) - Ionen, so falle elementares Kupfer an, das selbst eine geringe Affinität zu Säuren habe. Genauso verhalte es sich mit Eisen, das im Vergleich zu Kupfer besser löslich in Salzsäure sei. [26]
3.6.5. Erklärung heute
Eine Erklärung für oben beschriebenes Phänomen liefert heute die Elektrochemie und die so genannte Elektromotorische Kraft (EMK). Die EMK lässt sich nach folgender Formel aus den Normalpotentialen berechnen:
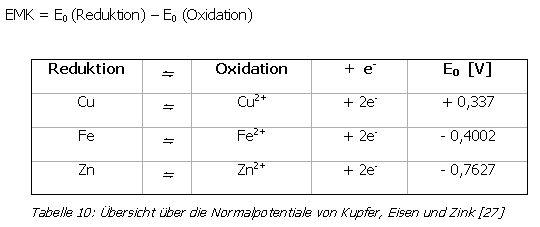
Im vorliegenden Beispiel wird Cu2+ zu Cu reduziert, Fe und Zn werden oxidiert. Die entsprechenden EMK-Werte lauten:

Die EMK-Werte sind positiv, das heißt die Reaktion kann spontan ablaufen. Für den umgekehrten Vorgang (Oxidation von Kupfer, Reduktion von Eisen bzw. Zink) würde sich ein EMK-Wert von - 0,737 V bzw. - 1,01 V ergeben. Die Reaktion kann nicht spontan ablaufen, das heißt elementares Kupfer kann Eisenionen (Fe2+) oder Zinkionen (Zn2+) nicht in ihren Lösungen reduzieren.
| 3-7. Darstellung von konzentrierter Salpetersäure (HNO3) mittels Trockendestillation | zum Seitenanfang  |
3.7.1. Reaktionsgleichungen
Folgende Reaktionen stehen miteinander im Gleichgewicht:
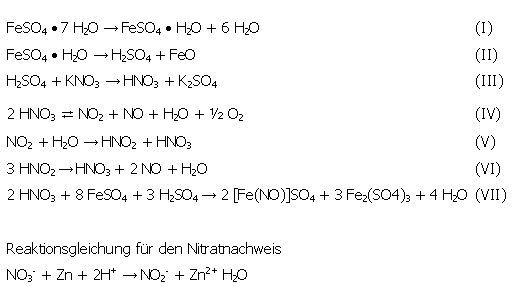
3.7.2. Versuchsdurchführung
verwendete Geräte
Destillationsapparatur mit folgenden Bestandteilen (s. Bild 16)
- Destillationskolben (250 mL)
- Claison - Aufsatz mit Thermometer
- Mohr - Kühler mit Gegenstromprinzip + 2 Wasserschläuche
- Vakuumvorstoß
- Vorlangenkolben (100 mL)
- Ölbad mit Thermometer
- Teklubrenner, Drahtnetz, Keramikplatte
darüber hinaus verwendete Geräte
- Uhrglas
- Pasteurpipette
- pH-Papier
verwendete Chemikalien:
- Kaliumnitrat (KNO3) reinst
- Eisensulfatheptahydrat (FeSO4 • 7 H2O) reinst
- Reagenzmischung aus Sulfanilsäure, a-Naphthyamin und Weinsäure
- Zinkpulver reinst
In den Destillationskolben werden ca. 7,1 g Kaliumnitrat (KNO3) und ca. 2,8 g Eisensulfatheptahydrat (FeSO4 • 7 H2O) eingewogen. [Hinweis zu den Gewichtsangaben: Kaliumnitrat und Eisensulfatheptahydrat müssen ungefähr im Verhältnis 1:7 (bezogen auf die molaren Massen) eingewogen werden, da aus 1 mol KNO3 1 mol NO2 entsteht, aus einem mol FeSO4 • 7 H2O 7 mol H2O]. Nachdem die Destillationsapparatur aufgebaut und angeschlossen wurde, wird vorsichtig erhitzt, wobei die Temperatur im Ölbad und die Dampftemperatur kontrolliert werden. Nach Destillationsende wird der Kühler mit wenig demineralisiertem Wasser ausgespült und das Destillat in einem geschlossenen Gefäß aufbewahrt.
Das Destillat ist anschließend auf Identität zu prüfen. Zunächst wird mit Indikatorpapier der pH-Wert geprüft. Hierzu wird ein Tropfen des Destillats mit der Pasteurpipette auf das pH-Papier gebracht und anhand eines Vergleichs mit der Farbskala der pH-Wert abgelesen. Für den Nitratnachweis werden 2 Tropfen des Destillates auf ein Uhrglas gegeben und mit einer Spatelspitze der Reagenzmischung versetzt. Anschließend wird eine Spatelspitze Zink zugesetzt.
3.7.3. Beobachtung und Ergebnis
Bei einer Ölbadtemperatur von 90 °C beginnt das Eisensulfatheptahydrat langsam zu schmelzen, wobei die Farbe von gelbgrün bis zu braun wechselt. Bei 100 °C beginnt Wasserdampf am Kolbenhals zu kondensieren. Die Nitrosegasentwicklung setzt bei 130 °C ein, der Rückstand im Destillationskolben bleibt fest und ist braun - gelb gefärbt. Bei etwa 153 °C sammeln sich die Nitrosegase im Vorlagenkolben. Der Destillationsbeginn ist nach 1,5 Stunden erreicht, wobei nach 2,5 Stunden 2 Tropfen Destillat gewonnen werden konnten.
Die Prüfung des pH-Wertes ergab einen pH von 1, ein Indiz dafür, dass eine relativ konzentrierte Säure entstanden sein muss. Der Nitratnachweis war ebenfalls positiv. Nitrit konnte nicht nachgewiesen werden, da die charakteristische Rotfärbung verursacht durch den Azofarbstoff erst nach Zugabe von Zink aufgetreten ist. Es konnte somit Salpetersäure hergestellt werden.
3.7.4. Bemerkung
Die für die Trockendestillation verwendeten Salze Kaliumnitrat und Eisensulfatheptahydrat wurden von Glauber ebenfalls synthetisiert. Dargestellt werden können sie folgendermaßen:
Reaktionsgleichungen: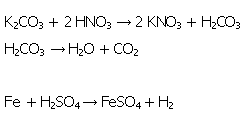
verwendete Geräte
- 3 Bechergläser (150 mL)
- Weißbandfilter
- Schnelllauftrichter
verwendete Chemikalien
- Kaliumcarbonat (K2CO3) reinst
- Phenolphthaleinlösung
- konzentrierte Salpetersäure [c(HNO3) ~ 14 mol/L]
- Eisenpulver (Fe)
- verdünnte Schwefelsäure [c(1/2 H2SO4) ~ 2 mol/L]
Für die Darstellung von Kaliumnitrat werden 20 g Kaliumcarbonat in 40 mL heißen demineralisiertem Wasser gelöst und mit 1-2 Tropfen Phenolphthaleinlösung versetzt. Anschließend wird soviel halbkonzentrierte Salpetersäure zugesetzt bis sich die Lösung vollständig entfärbt hat. In der erkalteten Lösung kristallisiert Kaliumnitrat aus (s. Bild 14).
Für die Darstellung von Eisensulfatheptahydrat werden 4 g Eisenpulver in 50 mL verdünnter Schwefelsäure gelöst. Das nicht gelöste Eisen wird durch Weißbandfilter abfiltriert. In der erkalteten Lösung kristallisiert Eisensulfatheptahydrat als grüne Kristalle aus (s. Bild 13).
3.7.5. Beobachtung und Schlussfolgerung Glaubers
Glauber erkannte, dass während des Prozesses der Trockendestillation rotbraune Gase aufsteigen, die er "spiritus nitri" (Geist des Salpeters, Stickstoffdioxid) nannte. Er bemerkte also richtig, dass dieser "spiritus" vom "nitrum" stammen muss. Durch Erwärmen des kristallwasserhaltigen Alauns entsteht Wasserdampf, der als Lösungsmittel für den "spiritus nitri" fungiert. Es entsteht konzentrierte Salpetersäure ("spiritus fumans Glauberi" = rote rauchende Salpetersäure).[28]
3.7.6. Erklärung heute
Im Wesentlichen unterscheidet sich die heutige Deutung des Ergebnisses kaum von den damaligen Erklärungsversuchen. Durch das Erwärmen des Eisenvitriols entsteht wenig Schwefelsäure (s. Reaktionsgleichung II), die das Kaliumnitrat zersetzt (s. Reaktionsgleichung III). Es entstehen Nitrosegase (s. Reaktionsgleichung IV), die überwiegend aus Stickstoffmonoxid und Stickstoffdioxid bestehen (s. Bild 15). Aus dem kristallwasserhaltigen Eisensulfat entweicht beim Erwärmen Wasserdampf (s. Reaktionsgleichung I), in dem sich die Stickstoffoxide unter Bildung von Salpetersäure (HNO3) und salpetriger Säure (HNO2) lösen (s. Reaktionsgleichungen IV Rückreaktion und V). Salpetrige Säure disproportioniert beim Erwärmen jedoch in Salpetersäure, Stickstoffmonoxid und Wasser (s. Reaktionsgleichung VI), sodass als Endprodukt lediglich reine Salpetersäure entsteht. Durch die Entstehung von Eisennitrosylsulfat (s. Reaktionsgleichung VII) ist der Rückstand braun gefärbt. Mit Hilfe des Reagenzgemisches kann verifiziert werden, ob sich im Destillationskolben Salpetersäure gesammelt hat. Wäre salpetrige Säure oder eine Mischung aus Salpetersäure und salpetriger Säure entstanden, so hätte bereits eine Rotfärbung vor Zugabe des Zinkpulvers auftreten müssen. Dies war jedoch nicht der Fall. Vielmehr musste das Nitrat - Ion erst zu Nitrit reduziert werden (s. Bild 17).
| 4. Diskussion und Ergebnis | zum Seitenanfang  |
Glauber hatte zur damaligen Zeit keine Möglichkeit seine Erklärungen auf eine solide theoretische Basis zu fundieren. Durch die Arbeit mit seinen Salzen und Säuren machte er jedoch viele Beobachtungen, die er zu deuten und einzusetzen wusste.
Die meisten seiner Denkansätze sind aus heutiger Sicht überholt, haben aber dennoch einen Beitrag zum modernen Verständnis chemischer Reaktionen geliefert. So wusste Glauber beispielsweise wie er Silberchlorid herstellen konnte, eine befriedigende Deutung seiner Beobachtungen konnte er jedoch nicht liefern. Sie folgte erst später, nachdem das theoretische Wissen um die Löslichkeit und die Löslichkeitsprodukte erworben war. Glaubers aus heutiger Sicht recht einfache Deutungsweisen können trotzdem als korrekt betrachtet werden. So behauptete er, Ammoniumchlorid entstehe aus Salzsäure und Ammoniak, die sich gegenseitig 'töteten' und ein Salz bildeten. Eine Neutralisationsreaktion kann mit einfachen Worten durchaus in dieser Form beschrieben werden.
Genau aus diesem Grund wird Glauber als einer der "Väter der modernen Chemie" genannt, da er viele verfahrenstechnische Verbesserungen einführte und in einigen Punkten eine für die damalige Zeit fortschrittliche Denkweise zeigte.
Im Hinblick auf die noch unbestimmte Definition des Salzbegriffes brachte er eine Neuerung hervor, indem er eine erste Klassifizierung vornahm. Er unterschied zwischen den einfachen, unvermischten Salzen (z. B. Natriumchlorid) und den Vitriolen und Alaunen (die keine einfachen Salze darstellten). Die 'Alkali', die alkalischen Salze bildeten eine 3. Gruppe und werden aus Holzasche oder natürlichem Vorkommen gewonnen (z. B. Kaliumcarbonat). Zudem konnte er wenigstens nachweisen, dass Salze durch das Einwirken von Säuren auf Metalle entstehen. Auch seine Ansicht, dass alle Salze aus einem sauren und einem alkalischen Teil bestehen, ist aus damaliger Sicht als modern zu beurteilen. [29]
Offen bleibt die Frage, ob Glauber als Alchemist zu bezeichnen ist. In der Literatur finden sich dazu unterschiedliche Angaben. Seine Lebensdaten fallen ins Zeitalter der Alchemisten und auch seine Darstellung chemischer Reaktionen ist als überwiegend alchemistisch einzustufen, da sich viele Analogien zu biologischen Prozessen finden. Glauber konnte keine fundierte Ausbildung vorweisen und war der Sprache der Gelehrten nicht mächtig. Einige seiner Verfahren brachten nicht den gewünschten Erfolg oder schlugen ganz fehl, sodass er oft als Scharlatan bezeichnet wurde. Dennoch distanziert sich Glauber von dem Hauptziel der Alchemisten Gold durch Transmutation (Verwandlung) herzustellen. Vielmehr ging es ihm um den materiellen Wohlstand Deutschlands, das durch den Krieg gebeutelt war. Seine Verfahren untersuchte er auf mögliche industrielle Nutzbarkeit und arbeitete sie dahingehend aus, dass sie eine gewerbliche Anwendung ermöglichten. Unumstritten bleibt, dass Glauber viele Fortschritte im Bereich der industriellen Chemie geleistet hat. Die Bezeichnung als einer der Väter der modernen Chemie ist also nicht unbegründet.
| 5. Summary | zum Seitenanfang  |
Johann Rudolph Glauber (1604 - 1670) was one of the most important chemists during his time. Influenced by an alchemist world of ideas he worked at different methods in order to synthesize salts and mineral acids. Glauber is said to have been the first chemist who could earn his living by selling the products he had syntethized.
During the work at that project I carried out a few experiments not only to understand Glaubers way of working but also to draw a comparison between the former and the modern explications of chemical reactions.
Alchemists and the former chemists already knew the phenomenon of precipitation and Glauber used it for example in order to gain silver chloride (working with a solution of silver nitrate from which he precipitated the cloride using diluted hydrochloric acid). He also precipitated lead chloride using the same method but working with a solution of lead nitrate and a diluted solution of sodium chloride. Alchemists who belived that all matter was composed of the four elements water, fire, earth and air explained their observations by assuming that the composition was changed so that each substance looses its properties. Glauber argued according to these assumptions.
Besides the phenomenon of sublimation was already known and showed by the heating of ammonium chloride. It seems to sublimate so that the formation of white smog can be noticed.
During his work Glauber put forward the thesis of the specific reaction of metals when dissolved for example in concentrated acid. He claimed that some metals are better soluble so that they force every other metal, which is worse soluble to precipitate from its solution. This fact can be prooved by adding elementary iron to a hot solution of copper oxyde in hydrochloric acid. The iron dissolves by forming iron(II)chloride, elementary red copper preciptiates. The modern explanation is based on the standard potentials. As copper is classified as a precious metal and iron as a non - precious metal, iron has a lower potential and dissolves whereas elementary copper is produced.
Glauber was also involved in the invention and improvement of chemical instruments. He developped for example a destillation apparatus to produce concentrated nitric acid and the method of a "dry destillation”. It means that the distillation is carried our by using solid substances (in this example potassium nitrate and iron sulfate with 7 moles of water of cristallization). He correctly observed that brown gases escape and form nitric acid when dissolved in water. The ascending gases are nitrose gases, the required water comes from the iron sulfate.
Glauber contributed much to the modern understandig of chemisty and chemical reactions. Although he wasn't able to explain the reasons of much of these reactions, he made many oberservations, which he conscientious used to produce required substances in an industrial standard. Therefore he is named one of the fathers of modern chemistry.
| Anhang: Literaturverzeichnis und Bilder | zum Seitenanfang  |
Literaturverzeichnis
| [1] | Arnulf Link, Inaugural Dissertation, 1993, S 74 - 85 |
| [2] | Arnulf Link, Inaugural Dissertation, 1993, S. 75 |
| [3] | Jean - Rémi Deléage, De L'alchimie à la chimie, Science et avenir (Dec. 1996), S. 45 |
| [4] | Arnulf Link, Inaugural Dissertation, 1993, S. 75 - 81 |
| [5] | http://www.asn-linz.ac.at/schule/chemie/entwch.htm, online 06.01.05 |
| [6] | Aline Kiner, De L'alchimie à la chimie, Science et avenir (Dec. 1996), S. 40 |
| [7] | http://www.encarta.msn.com/encyclopedia_761569628/chemie.html, online 06.01.05 |
| [8] | Prof. Dr. Schwedt, Glauber und sein Wundersalz, CLB Chemie in Labor und Biotechnik 09/2004, S. 328ff |
| [9] | http://es.rsc.org/chemistryworld/features/free/CW00409F0046.htm, online 06.01.05 |
| [10] | http://www.galileo.rice.edu/Catalog/NewFiles/glauber.html, online 31.08.04 |
| [11] | Arnulf Link, Inaugural Dissertation, 1993, S. 74 |
| [12] | http://www.rsc.org/lap/educatio/eic/2004/nicholson-jan04.html, online 06.01.05 |
| [13] | Arnulf Link, Inaugural Dissertation, 1993, S. 74 - 85 |
| [14] | Arnulf Link, Inaugural Dissertation, 1993, S. 75f |
| [15] | http://www.kremer-pigmente.de/64221.htm, online 06.01.05 |
| [16] | http://www.seilnacht.com/chemie/ch_naso4.htm, online 06.01.05 |
| [17] | Arnulf Link, Inaugural Dissertation, 1993, S. 82ff |
| [18] | Arnulf Link, Inaugural Dissertation, 1993, S. 77, Literaturangabe 219 |
| [19] | Latscha, Klein, Anorganische Chemie - Basiswissen 1, 2. Auflage 1996, Springer Verlag, 13. Chemisches Gleichgewicht, Löslichkeitsprodukt S. 251f |
| [20] | http://de2.uni-bielefeld.de/dc2/kristalle/dc2kv_5.htm, online 31.12.04 |
| [21] | Prof. Dr. Schwedt, Glauber und sein Wundersalz, CLB Chemie in Labor und Biotechnik 09/2004, S. 332 |
| [22] | Arnulf Link, Inaugural Dissertation, 1993, S 84 |
| [23] | Dobrinski, Krakau, Vogel, Physik für Ingenieure, Auflage 3 1974, B.G. Teubner Stuttgart 2. Wärmelehre, Verdampfen und Dampfdruck S. 149 |
| [24] | Werner Eisner et al., Elemente Chemie I, Unterrichtswerk für Gymnasien 1. Auflage 1996, 15 Einige Grundprodukte der chemischen Industrie (15.8. Eigenschaften und Reaktionen von Ammoniak) S. 83 |
| [25] | Arnulf Link, Inaugural Dissertation, 1993, S 77 |
| [26] | http://es.rsc.org/chemistryworld/features/free/CW00409F0046.htm, online 06.01.05 |
| [27] | Küster, Thiel, Rechentafeln für die chemische Analytik, 102. Auflage 1982, Walter de Gruyter Verlag, 8. Elektrochemie, 8.4.4 Normalpotentiale S. 144 |
| [28] | http://de2.uni-bielefeld.de/dc2/kristalle/dc2kv_5.htm, online 31.12.04 |
| [29] | Arnulf Link, Inaugural Dissertation, 1993, S 76 |
Bilder
 |
 |
| Bild 1: gefälltes Silberchlorid | Bild 2: gefälltes Bleichlorid |
 |
 |
| Bild 3: übersättigte Natriumsulfatlösung | Bild 4: auskristallisiertes Glaubersalz |
 |
 |
| Bild 5: getrocknetes Glaubersalz | Bild 6: Darstellung von Ammoniumchlorid |
 |
 |
| Bild 7: Kupfer in verdünnter Salzsäure | Bild 8: Kupferoxid in verdünnter Salzsäure |
 |
 |
| Bild 9: getrocknetes Kupfer(II)chlorid | Bild 10: Kupfer(II)-Salzlösung |
 |
 |
| Bild 11: Kupfer, gefällt mit Eisenpulver aus einer Kupfer(II)-Salzlösung | Bild 12: abfiltriertes Kupfer |
 |
 |
| Bild 13: selbst hergestelltes Eisensulfatheptahydrat | Bild 14: selbst hergestelltes Kaliumnitrat |
 |
 |
| Bild 15: Nitrosegasentwicklung beim Erhitzen von FeSO4 • 7 H2O und KNO3 | Bild 16: Aufbau der Destillationsapparatur |
 |
|
| Bild 17: pH-Wert-Prüfung, Nitratnachweis | |
>> Diese Projektarbeit komplett downloaden / ausdrucken (in PDF)
« zurück zur Übersicht - Projektarbeiten

