« zurück zur Übersicht - Projektarbeiten
"Iodierung von Carbonylverbindungen"
von Tanas Injac und Denis Saydjari (Schuljahr 2005/06)
| 1. Einführung | zum Seitenanfang  |
An Universitäten und Fachhochschulen werden im Rahmen des Chemiestudiums auch Praktika zur Reaktionskinetik durchgeführt. Diese beinhalten oft Untersuchungen und Messungen zu Aktivierungsenergien, Reaktionsgeschwindigkeiten, Reaktionsordnungen oder chemischen Gleichgewichten. An einigen Instituten wird die Ermittlung von Reaktionsgeschwindigkeiten und -ordnungen an einen bestimmten Beispiel gezeigt: der Iodierung von Aceton. Diese Reaktion eignet sich deshalb gut für solche Bestimmungen, da auf eine Umlagerung des Acetonmoleküls basiert, die großen Einfluss auf die Geschwindigkeit der Iodierung hat, und sie mit Stärke gut indizierbar ist. Aceton gehört zur Gruppe der Ketone, andere Vertreter mit einer Carbonylgruppe im Molekül sind Aldehyde oder auch Ester. Der Oberbegriff für diese Stoffe ist "Carbonylverbindungen".
Diese Projektarbeit soll den genannten Versuch mit Aceton nachstellen und weiterführend untersuchen, wie sich andere Carbonylverbindungen bei der Iodierung verhalten, bzw. ob sie überhaupt auf dieselbe Weise wie Aceton iodierbar sind, da bisher keine Veröffentlichungen zu dieser Thematik bekannt sind.
| 2. Aufgabenstellung | zum Seitenanfang  |
Ziel der Projektarbeit ist es, verschiedene, ausgewählte Carbonylverbindungen zu iodieren und festzustellen ob und wie diese Reaktionen verlaufen. Dies beinhaltet die Berechnung der Reaktionsordnungen aller an der Reaktion beteiligten Stoffe, sowie die Ermittlung der Reaktionsgeschwindigkeitskonstanten. Die Ergebnisse sollen auf Grundlage von Strukturmerkmalen und des Reaktionsmechanismus interpretiert, und mit dem Verhalten von Aceton verglichen werden. Im Ergebnis soll festgestellt werden, ob die untersuchten Stoffe ein Aceton-ähnliches Verhalten zeigen und damit ebenfalls für Versuche im Rahmen von physikalisch-chemischen Praktika geeignet sind.
| 3. Theoretische Grundlagen | zum Seitenanfang  |
| 3-1. Reaktionskinetik | zum Seitenanfang  |
| 3-1.1. Reaktionsgeschwindigkeit |
Unter der Reaktionsgeschwindigkeit versteht man die Konzentrationsänderung eines Stoffs während einer Reaktion pro Zeiteinheit. Diese Größe kann sich sowohl auf ein Reaktionsprodukt (die Konzentration steigt dann mit der Zeit) als auch auf ein Reaktionsedukt (die Konzentration sinkt mit der Zeit) beziehen. Ist sie auf ein Produkt bezogen hat die Reaktionsgeschwindigkeit v ein positives Vorzeichen, im anderen Fall ein negatives. Allgemein ist die Reaktionsgeschwindigkeit v also folgendermaßen definiert:
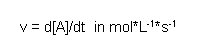
Statt mol*L-1*s-1 wird auch manchmal auch die Einheit mol/s verwendet. Dies ist dann möglich, wenn Laufe der Reaktion das Gesamtvolumen der Lösung konstant bleibt.
Die Reaktionsgeschwindigkeit hängt vor allem davon ab, wie schnell die reagierenden Moleküle den Übergangszustand mit dem höchsten Energieniveau erreichen. Das geschieht umso schneller, je geringer die Aktivierungsenergie ist und je wahrscheinlicher reaktionsaktive Zusammenstöße der Moleküle sind.
| 3-1.2. Reaktionsordnungen |
|
Die Reaktionsgeschwindigkeit ist daher in der Regel abhängig von der Stoffmengenkonzentration der Ausgangssubstanzen. Diese Abhängigkeit lässt sich mithilfe von Reaktionsordnungen kategorisieren. Von Reaktionen 1. Ordnung spricht man zum Beispiel bei Zerfallsreaktionen. Die Reaktionsgeschwindigkeit ist dann (außer von der Temperatur) nur davon abhängig, wie viele Teilchen A am Anfang vorhanden sind. Die Reaktionsgeschwindigkeit v und die Stoffmengenkonzentration c zur Zeit t verhalten sich also proportional zueinander. Der Proportionalitätsfaktor wird als Geschwindigkeitskonstante k der Reaktion bezeichnet. Der Name "Konstante" ist hier nicht völlig richtig, da k auch von der Temperatur abhängt. Die Temperatur taucht also nicht in den Formeln für die Reaktionsgeschwindigkeit auf, da sie in der Konstanten k schon integriert ist. |
|
| Für Reaktionen 1. Ordnung gilt also: | v = k*c(A) |
| Ein Beispiel für eine Reaktion 2. Ordnung ist die Reaktion zweier Moleküle A und B zu einem oder mehreren Produkten. Die Anzahl der Zusammenstoßmöglichkeiten, (also die Wahrscheinlichkeit) ist von der Anzahl beider Teilchen abhängig. Liegt Teilchen A im starken Überschuss vor, ist die Wahrscheinlichkeit eines Zusammenstoßes mit B geringer, als wenn beide Moleküle zu gleichen Teilen vorliegen. | |
| Für Reaktionen 2. Ordnung gilt: | v = k*c(A)*c(B) |
| Eine Ausnahme von der Abhängigkeit der Reaktionsgeschwindigkeit von der Stoffmengenkonzentration bilden Reaktionen 0. Ordnung. Ein Beispiel dafür sind Elektrolysen. | |
| Für Reaktionen 0. Ordnung gilt demnach | v = k |
Reaktionsordnungen können allerdings nicht nur für ganze Reaktionen, sondern auch für einzelne Reaktanden angegeben werden. So kann zum Beispiel eine Reaktion mit mehreren Edukten bezüglich eines einzelnen Edukts eine bestimmte Ordnung haben, bezüglich eines anderen Edukts aber eine völlig andere. Die Gesamtordnung einer Reaktion ist daher außerdem noch definiert als die Summe der Ordnungen der einzelnen Edukte.
Bei unserer Projektarbeit werden die Reaktionsordnungen ausschließlich für jede Ausgangssubstanz einzeln ermittelt. Die Ordnung der Gesamtreaktion spielt hier eine untergeordnete Rolle, da sie eher für größere technische Prozesse oder Synthesen interessant ist.
Für die Reaktionsgeschwindigkeit gilt hier:
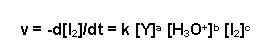
| v | Reaktionsgeschwindigkeit in mol*L-1*s-1) |
| d[I2] | Iodkonzentration, die während der Reaktion umgesetzt wurde in mol/L |
| dt | Dauer der Reaktion in Sekunden |
| k | Reaktionsgeschwindigkeitskonstante |
| [Y] | Ausgangskonzentration des Stoffes Y in mol/L |
| a,b,c | Reaktionsordnungen des jeweiligen Stoffs |
(Quellen: siehe Literaturverzeichnis, Nr.1-4)
| 3-2. Reaktionsmechanismen | zum Seitenanfang  |
Ein Aceton-Molekül kann nicht so einfach iodiert werden, da es nur eine Angriffsstelle an der CO- Doppelbindung gibt.
Das Iod-Atom findet sich aber später nicht am Kohlenstoff der CO-Doppelbindung sondern an den Alpha-Kohlenstoffen.
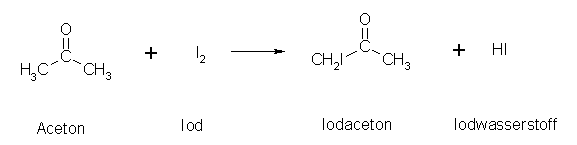
Wie hat das Iod nun mit Aceton reagiert?
Um dies zu verstehen muss man erst einmal den Sachverhalt der Keto-Enol-Tautomerie genauer unter die Lupe nehmen.
| 3-2.1. Keto-Enol-Tautomerie |
Eine Tautomerie bezeichnet allgemein eine Umlagerung von Atomen oder Atomgruppen in einem Molekül.
Die Keto-Enol-Tautomerie speziell zwischen Keto- oder Aldehydgruppen und Enolen, das sind ungesättigte Alkohole.
Es liegen in saurer und basischer Lösung immer beide Formen vor.
Je nach pH-Wert findet entsprechend eine Katalyse mit Säure oder Base statt.
Basen-katalysierte Keto-Enol-Tautomerie am Beispiel Ethenol bzw. Acetaldehyd (Ethanal):
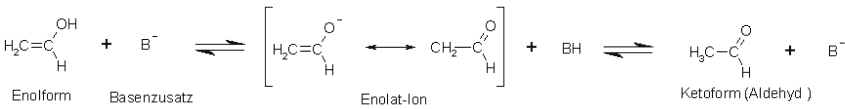
Beim Basenkatalysiertem Prozess wird die Hydroxyl-Gruppe durch den Basenzusatz deprotoniert.
Anschließend erfolgt ein Angriff am Kohlenstoff-Atom, der die stabilere Keto- (Aldehydform) hervorbringt.
Die Base fungiert als Katalysator und geht aus der Reaktion wieder unversehrt hervor.
Säure-Katalysierte Keto-Enol-Tautomerie am Beispiel Ethenol bzw. Acetaldehyd (Ethanal):
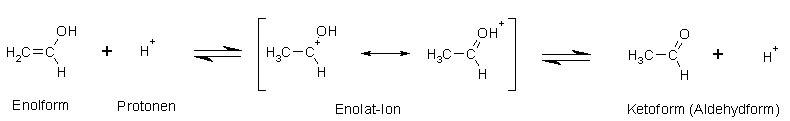
Beim säurekatalysierten Prozess wird die Doppelbindung einfach protoniert, wodurch eine Elektronenlücke am Kohlenstoff entsteht.
Diese wird durch ein freies Elektronenpaar des Sauerstoffs der Hydroxylgruppe geschlossen, wodurch am Sauerstoff eine positive Ladung entsteht.
Nun wird noch das Proton der Hydroxylgruppe abgespalten und es entsteht die Keto- (Aldehyd)-form und der Katalysator in Form von Protonen ist wieder frei.
Gleichgewichtszustände:
Normalerweise liegen die Gleichgewichte zwischen Keto- und Enolform deutlich auf der Seite der Ketoform, die Enolform findet man nur in Spuren (pK-Werte um 6-9, je nach Anzahl und Art der Substituenten). Trotzdem finden sich teilweise sehr hohe Umwandlungsbarrieren (Acetaldehyd-Vinylalkohol). Dieser Sachverhalt verdeutlicht die Bedeutung der Katalyse für die Reaktion bzw. Umwandlung
Beispiele:

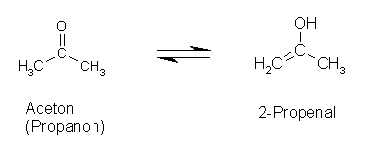
Es gibt aber auch Beispiele, bei denen das Gleichgewicht nahezu auf der Seite der Enolform liegt:
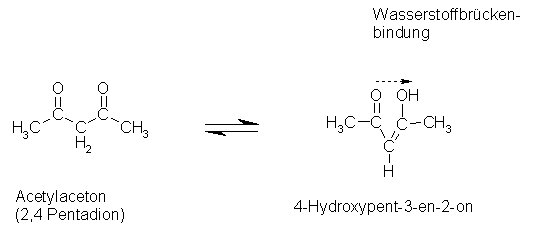
Meist besitzen diese Moleküle 2 Ketogruppen wie in unserem Beispiel.
Die Gründe für die Stabilität des Acetylacetons liegen zum einen an der Ausbildung eines konjugierten Systems, welches immer eine Stabilisierung eines Moleküls zur Folge hat, zum anderen daran, dass es zu einer stabilisierenden intramolekularen Wasserstoffbrückenbindung zwischen Keto- und Hydroxylgruppe kommt. So bildet sich ein spannungsfreier, sechsgliedriger Ring, ähnlich der Benzolstruktur.
Kommen wir nun zum Mechanismus der Halogenierung (in unserem Fall Iodierung) von Aldehyden und Ketonen, die meistens am alpha C-Atom der Carbonylgruppe verläuft.
| 3-2.2. Reaktionsmechanismus am Beispiel von Aceton |
Der erste Schritt ist die Enolisierung. Da dies der langsamste Schritt ist, ist er zugleich der geschwindigkeitsbestimmende Schritt.
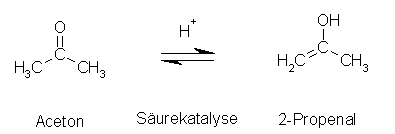
(Mechanismus des ersten Schrittes siehe Säure-katalysierte Keto-Enol-Tautomerie)
Nun folgt der 2.Schritt, der Angriff des Iods:
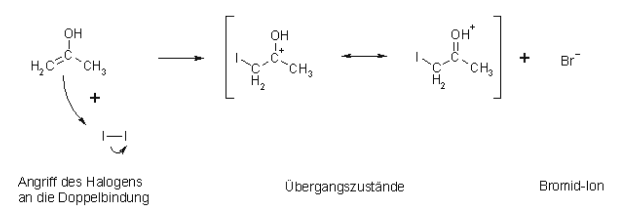
Anschließend erfolgt der 3. und letzte Schritt, die Deprotonierung bzw. Abspaltung des Protons:
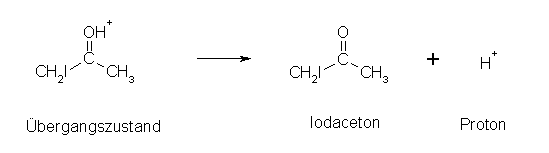
Sobald das erste Halogenatom ins Molekül eingebaut ist, verläuft nach säurekatalysierter Reaktion eine weitere Halogenierung nur noch schleppend ab. Normalerweise werden dann solange nichthalogenierte Ketone bzw. Aldehyde halogeniert, bis sie verbraucht sind. Erst dann tritt eine weitere Halogenierung am Halogenketon bzw. -aldehyd ein.
Gründe für dieses Verhalten:
Das halogenierte Produkt müsste, um weiter halogeniert zu werden nochmals enolisiert werden. Durch den Halogensubstituenten gibt es am Molekül aber einen -I-Effekt (elektronenziehende Wirkung), der die zur Enolisierung notwenige Protonierung erschwert, indem das zu protonierende Sauerstoff-Atom deutlich schwächer basisch wirkt.
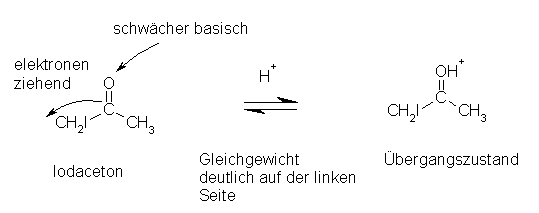
(Quelle: siehe Literaturverzeichnis, Nr.5)
| 3-2.3. Gesamtgleichungen |
Bei allen Reaktionen findet die Iodierung durch eine elektrophile Addition an die Enolform statt.
Die (theoretischen) Gesamtreaktionsgleichungen der einzelnen Iodierungen, ausgehend von den Enolformen der einzelnen Carbonylverbindungen lauten wie folgt:
Aceton:
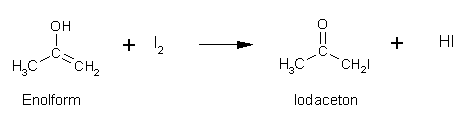
Propanal:
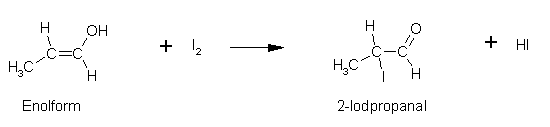
2,4-Pentandion:
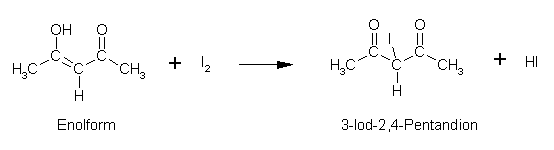
Essigsäureethylester:
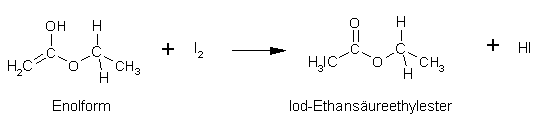
| 4. Durchführung | zum Seitenanfang  |
| 4-1. Benötigte Chemikalien und Geräte | zum Seitenanfang  |
Zur Durchführung der Iodierung im Rahmen einer physikalisch-chemischen Messung werden folgende Geräte und Chemikalien benötigt:
Geräte:
- Temperierbares Wasserbad oder Eintauch-Thermostat
- 50mL- oder 100mL-Meßkolben
- Stoppuhr
- Reagenzgläser (Makromaßstab)
- 5mL-, 10mL-Meßpipetten oder Vollpipetten
Chemikalien:
- Salzsäure (c = 1 mol/L)
- Stärkelösung (w = 0,1%)
- Iodkaliumiodid-Lösung (c = 0,01 mol/L)
- Wässrige Lösung des zu untersuchenden Lösemittels (hier: Carbonylverbindung)
c = 4 mol/L
| 4-2. Auswahl der zu untersuchenden Substanzen | zum Seitenanfang  |
Bei der Auswahl der Substanzen orientierten wir uns an den Vorschlägen von Herrn Dr. Schunk.
Die Auswahl der Substanzen verlief nach folgenden Kriterien:
- Mischbarkeit mit Wasser
- Vorhandensein eines α-C-Atoms für die Keto-Enol-Tautomerie
- Mindestens eine Verbindung mit zwei Carbonylgruppen im Molekül
Folgende Substanzen wurden ausgewählt:
- Aceton (Wiederholung des im "Experiment des Monats 08/1999" beschriebenen Versuchs, siehe Literaturverzeichnis Nr. 3)
- Propanal, als ein Vertreter der Aldehyde
- Essigsäureethylester (Ethylacetat) als ein Vertreter der Ester
- 2,4-Pentandion (Acetylaceton) aufgrund des Vorhandenseins von zwei Carbonylgruppen pro Molekül
| 4-3. Einstellung, Haltbarkeit und Entsorgung der Lösungen | zum Seitenanfang  |
Bei exakter Arbeitsweise beim Ansetzen müssen die Lösungen nicht eingestellt werden, da für eine qualitative Aussage die ungefähren Konzentrationen ausreichen. Das Einstellen der Lösungen macht insofern auch wenig Sinn, da Start und Ende der Reaktion mit der Stoppuhr gemessen werden [und nicht zum Beispiel durch eine photometrische Messung]. Es wird daher angenommen, dass der Fehler durch die manuelle Zeitmessung und die manuelle Erkennung der Entfärbung größer ist, als der Einfluss von geringen Konzentrationsabweichungen.
Die eingesetzten Lösungen sind in der Regel einige Wochen haltbar. Stärkelösung kann durch Zugabe von wenigen Kristallen Quecksilber(II)-chlorid resistent gegen Bakterien gemacht werden und wird damit über längere Zeit stabilisiert. Die Iodkaliumiodid-Lösung sollte verschlossen und dunkel aufbewahrt werden und ist dann ebenfalls über einige Wochen hinaus haltbar.
Nach der Reaktion werden die Lösungen als nichthalogenierte, organische Lösungsmittel entsorgt.
| 4-4. Vorgehen bei der Messung (am Beispiel von Aceton) | zum Seitenanfang  |
Zu Beginn der Messung werden die entsprechenden Volumina an Aceton-Lösung, Salzsäure, Stärkelösung und Wasser in einen 100mL Messkolben gegeben und gut geschüttelt. Der Messkolben wird anschließend in den Thermostat getaucht, der auf 30°C eingestellt ist. Die Lösung wird 10 Minuten thermostatisiert, um sicherzugehen, dass die Reaktion bei einer bestimmten, konstanten Temperatur abläuft.
Dann wird die Iodkaliumiodid-Lösung zugegeben, gut geschüttelt und die Zeitmessung gestartet. Je nach Frische der Iodlösung entsteht sofort der blaue Iod-Stärke-Komplex oder eine grünbraune Lösung durch überschüssiges Iod, der dann erst nach einigen Sekunden der blaue Komplex folgt. Die Zeitmessung wird beendet, wenn die Lösung farblos ist. Dann hat sich der Iod-Stärke-Komplex aufgelöst, da alles Iod reagiert hat. Die Zeit wird notiert und die Messung zur Bildung eines Mittelwerts 2x wiederholt.
Die Temperatur hat großen Einfluss auf die Reaktionsgeschwindigkeit und ist somit innerhalb aller Messreihen konstant zu halten.
Folgende Messreihen wurden durchgeführt (jeweils bei genau 30°C):
Aceton
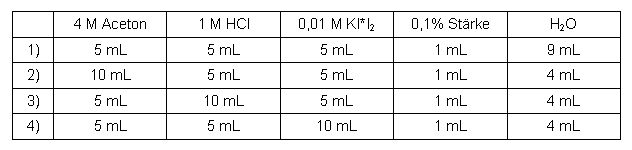
Tabelle 1: Messreihe Aceton
Propanal
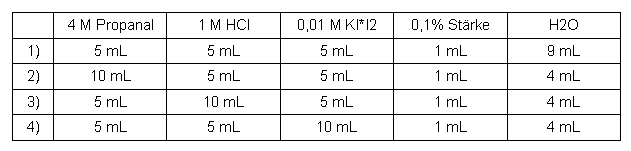
Tabelle 2: Messreihe Propanal
2,4-Pentandion
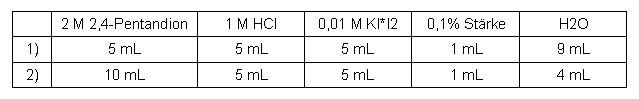
Tabelle 3: Messreihe 2,4-Pentandion
Essigsäureethylester
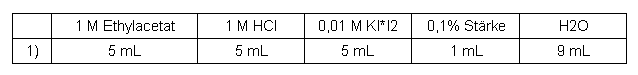
Tabelle 4: Messreihe Essigsäureethylester
Von dieser Substanz wurde aufgrund der geringen Wasserlöslichkeit von 85 g/L (~1 mol/L) lediglich eine weniger konzentrierte Lösung angesetzt und damit versucht die Reaktion zuerst qualitativ durchzuführen.
| 4-5. Vorgehen bei der Auswertung | zum Seitenanfang  |
Zur Bestimmung der Reaktionsordnungen der einzelnen Reaktionspartner wird die "Methode der Anfangsgeschwindigkeiten" angewandt. Das bedeutet es wird näherungsweise angenommen, dass durch die geringe Iodkonzentration die Reaktionsgeschwindigkeit zu jedem Zeitpunkt gleich der Anfangsgeschwindigkeit ist.
Aus den ermittelten Zeiten und der Iodkonzentration kann die Reaktionsgeschwindigkeit jeder Messreihe ermittelt werden. Für die Reaktionsgeschwindigkeit gilt wie in Kapitel 3.1.2 beschrieben:
![]()
Wird die zugegebene Menge eines Stoffes verdoppelt, verdoppelt sich auch seine Konzentration. Es gilt dann z.B. für Aceton:
![]()
Bildet man den Quotienten ergibt sich:
![]()
Analog verhält es sich mit allen Reaktionspartnern. v' bzw. v lassen sich durch Messung der Zeit von der Iodzugabe bis zur Entfärbung der Lösung berechnen, wobei v stets für die Geschwindigkeit der ersten Reaktion steht, und v' jeweils für alle anderen Reaktionen, bei denen die Konzentration einer der Reaktionspartner geändert, bzw. verdoppelt wurde.
Sind alle Reaktionsordnungen bekannt, lässt sich mit der Gleichung aus Kapitel 3.1.2 die Reaktionsgeschwindigkeitskonstante k berechnen.
| 5. Messwerte, Auswertung | zum Seitenanfang  |
| 5-1. Aceton | zum Seitenanfang  |
Messwerte:
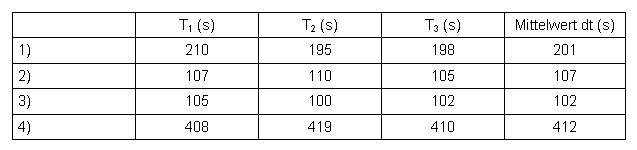
Tabelle 5: Messwerte Aceton
T1-T3 ... Reaktionszeit der Proben 1-3 in Sekunden
Auswertung:
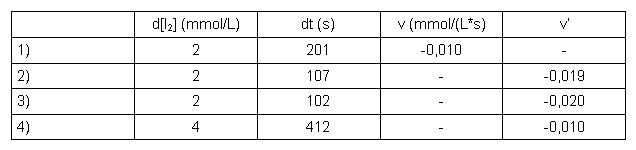
Tabelle 6: Auswertung Aceton
| d[I2] | eingesetzte Iodkonzentration |
| dt | gemessene Reaktionszeit |
| v | Reaktionsgeschwindigkeit v = -d[I2]/dt |
| v' | Reaktionsgeschwindigkeit v' = -d[I2]/dt bei der die Konzentration eines Stoffs verdoppelt wurde |
Die Reaktionsordnung ergibt sich aus: v'/v = 2a (vgl. Kapitel 5.5) damit ist die Reaktionsordnung: a = log(v'/v) / log2
Reaktionsordnungen:
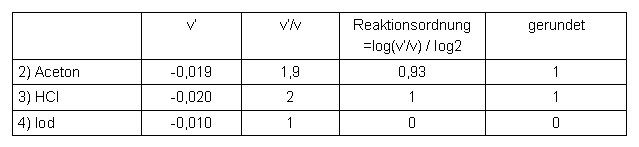
Tabelle 7 Reaktionsordnungen bei der Iodierung von Aceton
Berechnung der Geschwindigkeitskonstanten k aus der Gleichung 3.1.2:
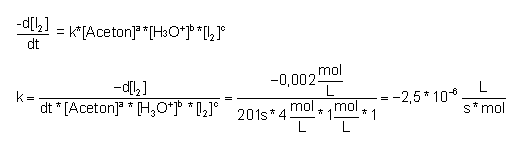
| 5-2. Propanal | zum Seitenanfang  |
Messwerte:
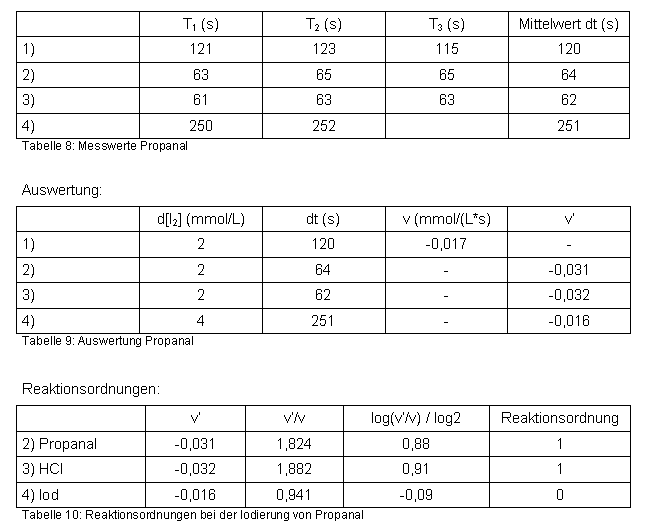
Berechnung der Geschwindigkeitskonstanten k aus der Gleichung 3.1.2:
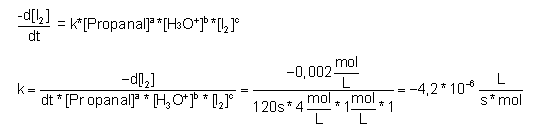
| 5-3. 2,4-Pentandion (Acetylaceton) | zum Seitenanfang  |
Bei dieser Substanz konnten keine Messwerte ermittelt werden, da sich die Lösung auch nach mehreren Stunden nicht entfärbte. Folgende Beobachtungen wurden festgehalten:
Die Lösung färbte sich nach Zugabe der Iodlösung zuerst dunkelgrün, nach ca. 5 Minuten trat der lilafarbene Iod-Stärke-Komplex auf. Diese Färbung blieb auch einer Erhöhung der Temperatur auf 40°C bestehen. Nachdem die Lösung über Nacht stehen gelassen wurde zeigte sich ebenfalls keine Änderung mehr. Zwei weitere Versuche mit der doppelten Menge an Acetylacetonlösung bzw. doppelter Menge an Salzsäure brachten dasselbe Ergebnis. Die Bestimmung von Reaktionsgeschwindigkeiten bzw. Reaktionsordnungen war daher nicht möglich.
| 5-4. Essigsäureethylester (Ethylacetat) | zum Seitenanfang  |
Bei dieser Substanz konnten keine Messwerte ermittelt werden, da sich die Lösung auch nach mehreren Stunden nicht entfärbte. Folgende Beobachtungen wurden festgehalten:
Nach Zugabe der Iodlösung waren 2 Phasen erkennbar. Die obere Phase färbte sich gelb, während die untere Phase den lilafarbenen Iod-Stärke-Komplex bildete. Da sich die Konzentration der Ethylacetatlösung an der Grenze zur Löslichkeit bewegte, ist davon auszugehen, dass es sich bei der oberen Phase um eine unlösliche, organische Phase aus Ethylacetat handelte. Beim Schütteln der Lösung wurde vermutlich ein Teil des Iods in die organische Phase ausgeschüttelt, sodass sich ein Verteilungsgleichgewicht einstellte. Zu erkennen war dies daran, beide Phasen nun eine Färbung aufwiesen, die der von Iod (gelb) bzw. Iod-Stärke (lila) entspricht. Dieser Zustand blieb auch über Nacht stabil. Die Bestimmung Reaktionsgeschwindigkeiten bzw. Reaktionsordnungen war daher nicht möglich.
| 6. Ergebnisse und Interpretation, Zusammenfassung | zum Seitenanfang  |
Aceton
Unsere Messungen bestätigten die Ergebnisse, die im "Experiment des Monats 08/1999" vorhergesagt wurden. Die Reaktion von Aceton mit Iod läuft hinsichtlich des Acetons mit der Ordnung 1 und hinsichtlich der Salzsäure (Katalysator für die Keto-Enol-Umlagerung) ebenfalls mit der Ordnung 1 ab. Die Konzentration des Iods hat keinen Einfluss auf die Reaktionsgeschwindigkeit. Grund dafür ist die Keto-Enol-Umlagerung, die gemessen zur eigentlichen Iodierung viel langsamer abläuft. Die Enol-Form wird sofort nach Entstehen iodiert, wodurch das Gleichgewicht ständig die Enol-Form nachliefern muss, bis das Iod komplett verbraucht ist.
Die Reaktionsgeschwindigkeit ist dagegen direkt von der Acetonkonzentration abhängig. Die Erklärung dafür ist, dass die Enol-Form zu einem kleinen Prozentsatz schon von Anfang an vorliegt (Gleichgewicht!). Wird mehr Aceton eingesetzt, steigt auch die Anzahl der Teilchen in Enol-Form in der Lösung und ebenso die Anzahl der Enol-Form-Teilchen, die pro Zeiteinheit vom Gleichgewicht nachgeliefert werden. Die Reaktion ist dadurch bei doppelter Acetonkonzentration nach etwa der halben Zeit beendet.
Die 1. Ordnung bezüglich der Salzsäure (genauer: der Protonen) lässt sich dadurch erklären, dass die Bildung der Enol-Form von Protonen katalysiert wird. Eine Verdoppelung der Salzsäurekonzentration hat auch hier eine Halbierung der Reaktionsgeschwindigkeit zur Folge.
Propanal
Das Experiment ergab, dass Propanal auf die gleiche Weise iodierbar ist wie Aceton. Mit Propanal wurden die gleichen Reaktionsordnungen ermittelt. Dies deutet darauf hin, dass auch hier die Umlagerung zur Enol-Form der langsamere und damit reaktionsbestimmende Schritt ist. Auffällig ist, dass Propanal mit Iod insgesamt erheblich schneller reagiert, was auch durch die höhere Geschwindigkeitskonstante deutlich wird. Grund dafür könnte sein, dass bei Propanal von vornherein der Anteil der Enol-Form höher ist und/oder die Umlagerung zur Enol-Form schneller abläuft. Allerdings sind Aldehyde im Allgemeinen auch reaktionsfreudiger als Alkanone. Der Einfluss der Salzsäure bzw. der Protonen auf die Bildung des Enols hat sich durch die Verwendung eines Aldehyds statt eines Ketons nicht verändert. In beiden Fällen liegt Reaktionsordnung 1 vor.
2,4-Pentandion (Acetylaceton)
Mit dieser Substanz war keine Auswertung möglich, da keine Entfärbung und somit keine Indikation des Reaktionsendes stattfand. Nach der Bildung des Iod-Stärkekomplexes trat keine weitere sichtbare Änderung auf. Das lässt darauf schließen, dass das Iod nicht, bzw. nicht vollständig verbraucht wurde. Die Struktur der Substanz in der Enolform (Abbildung) lässt darauf schließen, dass innerhalb des Moleküls die Ausbildung von Wasserstoffbrücken möglich ist.
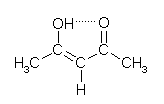
Abbildung: Enol-Form von Acetylaceton
Diese Wechselwirkungen könnten die Addition von Iod erschwert oder verhindert haben.
Ein Grund für das negative Ergebnis des Versuchs könnte also die sehr stabile Enol-Form des Acetylacetons sein (4-Hydroxypent-3-en-2-on), die aufgrund eines konjugierten Systems und einer Ausbildung eines spannungsfreien Rings eine dem Benzol ähnliche Struktur aufweist und deshalb auch nicht so ohne weiteres iodiert werden kann.
Denkbar wären allerdings auch sterische Hinderungen, zum Beispiel durch die Größe der Sauerstoffatome, die relativ nah beieinander liegen. Außerdem gibt es 4 freie Elektronenpaare im Molekül die durch ihre hohe Elektronendichte den Angriff des Iodmoleküls (6 freie Elektronenpaare) an der Doppelbindung, und somit dessen Spaltung verhindert haben könnten.
Essigsäureethylester
Auch mit dieser Substanz war keine Auswertung möglich, da die Wasserlöslichkeit dieses Esters zu gering ist; die höchstmögliche Konzentration beträgt circa 1 mol/L. Diese wurde zwar zur Bildung einer qualitativen Aussage auch eingesetzt, jedoch bildeten sich im Reaktionsgefäß dennoch 2 Phasen. Ein Teil des Iods löste sich aus der wässrigen Phase und trat in die organische Phase über. Dadurch war die Iodkonzentration jeweils unbekannt und eine Auswertung selbst bei Entfärbung des Iod-Stärke-Komplexes (die nicht eintrat) nicht möglich gewesen. Es ist davon auszugehen, dass die Verwendung von Essigsäure-methylester ein positives Ergebnis zur Folge gehabt hätte, jedoch stand uns diese Substanz nicht mehr rechtzeitig zur Verfügung.
Zusammenfassung:
Die durchgeführten Iodierungen an ausgewählten Carbonylverbindungen waren nur zum Teil erfolgreich. Die bekannten Resultate bei der Iodierung von Aceton, insbesondere die einzelnen Reaktionsordnungen konnten nachgestellt und bestätigt werden. Die Untersuchung von Propanal ergab, dass es sich im Verhalten bei der Iodierung lediglich in der Geschwindigkeit von Aceton unterscheidet. Die Reaktionsordnungen waren mit denen von Aceton identisch. Die Untersuchung von Acetylaceton ergab, dass dieser Stoff nicht auf dieselbe Weise wie Aceton iodierbar ist, zumindest nicht innerhalb eines zur Auswertung vernünftigen Zeitrahmens von 24 Stunden. Essigsäureethylester konnte aufgrund seiner geringen Wasserlöslichkeit nicht so iodiert werden, dass Vergleiche mit Aceton möglich wären, da man die Konzentration erheblich hätte verringern müssen.
Summary:
The iodinations of the selected carbonyl-compounds were only partially successful. The already known results about the iodination of acetone, especially the single reaction orders could be re-enacted and confirmed. The examination of propione aldehyde yielded, that it differs only in reaction speed from acetone. The reaction orders were identical with the ones from acetone. The examination of acetylacetone yielded, that this substance cannot be iondinated in the same manner as acetone, at least not within 24 hours, which was considered to be the reasonable timeframe for the reaction to take place. Acetic acid ethyl ester also could't be iodinated in ways that made comparisons with acetone possible due to his low water solubility. The concentration would have had to be lowered considerably.
| 7. Literaturverzeichnis | zum Seitenanfang  |
Friedrich Bergler: Physikalische Chemie für Chemisch-technische Assistenten.
Verlag Chemie Weinheim, 1991; Seiten 87-90Universität Bremen, Institut für Angewandte und Physikalische Chemie
http://www.chemie.uni-bremen.de/swiderek/pdf/kinv06-2005.pdf (26.01.2006)Dr. Axel Schunk: Experiment des Monats 08/1999, Universität Ulm
http://www.chemie.uni-ulm.de/experiment/edm0899.html (17.09.2005)Ulrich Helmich, Reaktionskinetik, Kapitel 7
http://www.u-helmich.de/che/11/kinetik/seite21.html (28.12.2005)K. P. C. Vollhardt, Neil E. Schore, K. Peter: Organische Chemie, 2.Auflage.
Verlag Chemie Weinheim; Seite 759 ff
>> Diese Projektarbeit komplett downloaden / ausdrucken (in PDF)
« zurück zur Übersicht - Projektarbeiten

