Experimente mit "Oxi-Reinigern"
 Einfache Experimente unter Verwendung von "Oxi-Reinigern" als Sauerstoffquelle: vom Sauerstoffnachweis durch "brennenden" Schaum über "Wunderkerzen" aus Topfschwamm-Draht und ein Hochofenmodell im Reagenzglas bis hin zur quantitativen Ermittlung des Sauerstoff-Gehaltes der freigesetzten gasförmigen Stoffe.
Einfache Experimente unter Verwendung von "Oxi-Reinigern" als Sauerstoffquelle: vom Sauerstoffnachweis durch "brennenden" Schaum über "Wunderkerzen" aus Topfschwamm-Draht und ein Hochofenmodell im Reagenzglas bis hin zur quantitativen Ermittlung des Sauerstoff-Gehaltes der freigesetzten gasförmigen Stoffe.
Die folgenden Versuchsvorschriften von Marco Rossow und Prof. Dr. Alfred Flint, Universität Rostock, stammen aus dem Vortrag "Chemie fürs Leben - Sauerstoff aus Oxi-Reinigern" bzw. aus dem Workshop "Stoffe aus dem Alltag im Chemieunterricht - Experimente mit Oxi-Reinigern", vorgetragen am Institut Dr. Flad im Rahmen der 12. Stuttgarter Chemietage.
Versuchsvorschriften: Experimente mit "Oxi-Reinigern"
Wichtiger Hinweis zu allen Versuchen |
Da die Hersteller von Oxi-Reinigern (für uns leider) die Zusammensetzung ihrer Produkte gelegentlich ändern, ist es unbedingt erforderlich, den gewünschten / gekauften Reiniger vor dem Einsatz im Unterricht zu testen!
So enthält beispielsweise das Nachfolgeprodukt des von uns verwendeten "Vanish Oxi action®", das "Vanish Oxi action max®", deutlich mehr Tenside. Diese können beim Erhitzen zersetzt werden. Dadurch kommt es zum einen zu einer deutlichen Rauchentwicklung. Zum anderen können brennbare Crackprodukte entstehen, die dann bei der Glimmspanprobe oder auch bei quantitativen Analysen in Verbindung mit dem ebenfalls freigesetzten Sauerstoff zu Verpuffungen führen können.
Auf folgende Weise kann nach dem derzeitigen Stand etwas Abhilfe geschaffen werden:
Zunächst ist die Körnung des zu verwendenden Reinigers zu prüfen. Geeignet sind solche Produkte, die Bestandteile mit unterschiedlicher Körnung enthalten. Einen solchen Reiniger kann man in ein Teesieb von "Fackelmann" geben (hat genau die geeignete Porengröße) und aussieben. Die meist eher feinkörnigen bis pulverförmigen Tenside fallen durch das Sieb, die das Natriumcarbonat-Peroxohydrat enthaltenden etwas gröberen Bestandteile bleiben im Sieb und können dann für die Experimente verwendet werden.
Bei mehreren Reinigern ist ein deutlicher Unterschied in der Körnung der einzelnen Bestandteile zu beobachten (Domol "oxi Aktivkraft", AS "Oxy", Heitmann "OXI"). Bei den grobkörnigen Bestandteilen handelt es sich in der Regel um das Natriumcarbonat-Peroxohydrat, bei den eher feinkörnigen Bestandteilen um die zugesetzten Tenside, Enzyme usw. Braucht man nun, wie in unseren Experimenten, das Bleichmittel möglichst ohne weitere Zusätze, so lässt es sich durch Sieben abtrennen. Wichtig ist allerdings die richtige Porengröße des Siebes! Unseren Erfahrungen nach eignen sich in besonderem Maße die Teesiebe der Firma Fackelmann®, mit denen man problemlos die für das Experiment nicht erwünschten Bestandteile durch mehrfaches Schütteln abtrennen kann. Im Sieb verbleibt dann das für das Experiment einsetzbare Bleichmittel weitgehend ohne weitere störende Zusatzstoffe. Der umwelt- und natürlich auch preisbewusste Experimentator wird die anderen Bestandteile beim Sieben selbstverständlich auffangen und sie einer weiteren Verwertung zuführen, schließlich kann man damit zumindest noch Fettflecken entfernen.
Nach Hinweis eines Kollegen haben wir festgestellt, dass in vielen Öko-Geschäften einzelne Waschmittel-Komponenten vertrieben werden. Dazu gehört auch ein Bleichmittel auf Sauerstoffbasis (z.B. Ecover®), welches keine Tenside, Enzyme oder andere ähnliche Bestandteile enthält und sich für die Experimente sehr gut eignet. 400 g dieses Bleichmittels kosten zwischen 2,49 € und 2,89 €.
Versuch 1: Untersuchung der "Reinigungswirkung" |
| Geräte/Chemikalien: | 150-mL-Becherglas, Heizplatte, Thermometer, "Hoffmanns Vanish Oxi action", Leinenlappen, Rotwein |
| Durchführung: | Auf dem Leinenlappen erzeugt man zunächst einen deutlichen Rotweinfleck. Dann füllt man das Becherglas etwa zur Hälfte mit Wasser, gibt einen Messlöffel "Hoffmanns Vanish Oxi action®" hinzu, taucht den Leinenlappen in die Lösung und stellt ein Thermometer hinein. Die Lösung wird allmählich auf einer Heizplatte erwärmt. Steht eine solche nicht zur Verfügung, kann man das Becherglas auch einspannen und die Lösung vorsichtig und langsam mit einem Brenner erwärmen. |
| Beobachtungen: | Beim Erwärmen wird der Rotweinfleck allmählich braun und entfärbt sich dann. Gleichzeitig setzt beginnend ab etwa 35°C eine mit steigender Temperatur immer heftiger werdende Gasentwicklung ein, es bildet sich eine Schaumschicht auf der Lösung. |
| Auswertung: | Offensichtlich wird durch das Reinigungsmittel der Rotweinfleck "gebleicht", dabei scheint das entstehende Gas eine Rolle zu spielen. |
Versuch 2: Nachweis von freigesetztem Sauerstoff (Kurzbeschreibung) |
In ein 150-mL-Becherglas gibt man ca. 75 mL Leitungswasser und erwärmt es auf 60°C. Dann fügt man ca. 15 g Oxi-Reiniger und einen kleinen Tropfen verdünnten Spülmittels (Spülmittel und Wasser im Verhältnis 1 : 3) hinzu. Man wartet, bis sich eine etwa 3 cm hohe Schaumkrone gebildet hat und sticht dann mit einem glühenden Holzspan in einzelne Blasen oder "rührt" den Schaum um. Insbesondere beim "Umrühren" leuchtet der glühende Span hell auf und beginnt zu brennen. Der Schaum sollte aus größeren Blasen bestehen, da ein zu feuchter, feinporiger Schaum das Entzünden des Spans verhindert.
Versuch 3: Erhitzen von "Hoffmanns Vanish Oxi action®" (Kurzbeschreibung) |
Man gibt in ein Reagenzglas etwa ein Gramm des Reinigers, erhitzt mit einem Brenner und hält nach kurzer Zeit einen glühenden Holzspan hinein, der dann spontan aufflammt. Bei Verwendung eines Halbmikro-Reagenzglases reicht schon das Erhitzen mit einer Kerze.
Versuch 4: Verbrennung von Holzkohle ohne und mit Zufuhr von Sauerstoff (Kurzbeschreibung) |
In ein schräg eingespanntes Reagenzglas gibt man etwa drei Zentimeter hoch "Hoffmanns Vanish Oxi action®", mit einem Abstand von etwa sechs Zentimetern darüber einen lockeren Bausch aus Glaswolle und darauf ein Stückchen Holzkohle. Zunächst wird nur die Holzkohle mit einem Brenner kräftig erhitzt, dann schwenkt man mit der Flamme auf den Reiniger.
Die Holzkohle beginnt schwach zu glühen, eine nennenswerte Reaktion ist aber nicht zu beobachten. Erhitzt man dann den Reiniger, leuchtet die Kohle hell auf und verbrennt mit leuchtender Flamme.
Versuch 5: Das Boudouard-Gleichgewicht (Kurzbeschreibung) |
In ein Duran-Reagenzglas (18 x 180 mm) gibt man ca. 5 - 6 cm hoch einen Oxi-Reiniger, darüber etwa 2 cm hoch kleine Tonscherben, überschichtet dann etwa 5 cm hoch mit vorher ausgeglühter gekörnter Aktivkohle (Körnung 2,5 mm oder größer) und sichert zum Abschluss den Inhalt durch einen Büschel Glaswolle. Das Reagenzglas wird senkrecht eingespannt und zunächst die Aktivkohle mit einem Brenner bis zu schwachen Rotglut erhitzt. Dann erwärmt man den Oxi-Reiniger und entzündet das oben am Reagenzglas austretende Gas.
Versuch 6: Der Hochofenprozess mit Oxi-Reinigern (Kurzbeschreibung) |
| Vorbereitung: | Wenn man nicht direkt Rost verwendet, muss pulveriges Eisenoxid (Fe2O3) vorher granuliert werden. Dazu tränkt man es mit Wasserglas, streicht es zu einer ca. 3 mm dicken Schicht z.B. auf einem Backblech aus, lässt es trocknen, löst es von der Unterlage und zerkleinert es mit einem Hammer auf Stecknadelkopfgröße. Die Aktivkohle muss vor dem Versuch ausgeglüht werden. Dann stellt man ein Rost- bzw. Eisenoxid/Aktivkohlegemisch im Massenverhältnis von 1 : 2 her. |
| Durchführung: | In ein Duran-Reagenzglas (18 x 180 mm) gibt man ca. 5 - 6 cm hoch einen Oxi-Reiniger, darüber etwa 2 cm hoch kleine Tonscherben, überschichtet dann etwa 5 cm hoch mit dem Aktivkohle/Eisenoxid-Gemisch und sichert zum Abschluss den Inhalt durch einen Büschel Glaswolle. Das Reagenzglas wird senkrecht eingespannt und zunächst das Aktivkohle/Eisenoxid-Gemisch mit einem Brenner bis zu schwachen Rotglut erhitzt. Dann erwärmt man den Oxi-Reiniger und entzündet das oben am Reagenzglas austretende Gas. Nach Beendigung des Versuchs lässt man das Reagenzglas erkalten, schüttet den Inhalt in eine Porzellanschale und prüft ihn auf Aussehen und mit einem Magneten. Es lassen sich kleine Eisen-Reguli finden, diese sind magnetisch. |
Versuch 7: "Knalleffekt" mit Wachs (Kurzbeschreibung, verändert nach [1]) |
In ein Reagenzglas (16 x 160 mm) gibt man etwa einen Zentimeter hoch einen Oxi-Reiniger, direkt darauf etwas Glaswolle und ein Stückchen Kerzenwachs. Das Reagenzglas wir senkrecht eingespannt, dann erhitzt man möglichst gleichzeitig das Wachs und den Reiniger. Nach kurzer Zeit erfolgt mit einem Knall eine heftige Verbrennung der Wachsdämpfe.
Achtung: Schutzbrille und Schutzscheibe verwenden, da das Reagenzglas zerspringen kann!
Versuch 8: "Verbrennung" von Stahldraht |

Eine Wunderkerze aus "Topfschwamm-Draht"
| Geräte/Chemikalien: | 300-mL-Erlenmeyerkolben, passender Stopfen, Stopfen (größer als die Öffnung des Erlenmeyerkolbens) mit Haken an der Unterseite, Reagenzglas, passender durchbohrter Stopfen mit kurzem Glasrohr, passendes Stück Schlauch zur Ableitung der Gase, "Hoffmanns Vanish Oxi action®", Stahldraht (von Topfreiniger aus Metall), Holzspan, Streichholz, Sand |
| Vorbereitung: | Man gibt in den Erlenmeyerkolben etwa einen Zentimeter hoch Sand. Dann entfernt man aus dem Topfreiniger drei ca. 20 Zentimeter lange Stahldrähte und verdreht sie miteinander. Ein Ende der verdrehten Stahldrähte wird an dem Haken des großen Stopfens befestigt, das andere Ende wickelt man drei- bis viermal um ein halbiertes Streichholz. Wenn man den Stopfen auf den Erlenmeyerkolben setzt, darf das Streichholz den Sand auf dem Boden nicht berühren. Nun gibt man ca. drei Gramm "Hoffmanns Vanish Oxi action®" in das Reagenzglas, setzt den durchbohrten Stopfen mit dem Glasrohr und dem angeschlossenen Stück Schlauch auf, hält diesen in den Erlenmeyerkolben und erhitzt dann den Reiniger. Mit Hilfe der Spanprobe kann der Füllstand des Kolbens mit Sauerstoff ermittelt werden. Ist der Kolben vollständig mit Sauerstoff gefüllt, verschließt man ihn mit dem passenden Stopfen. |
| Durchführung: | Zunächst versucht man, einen Stahldraht aus dem Topfreiniger mit dem Brenner zu entzünden. Dann entzündet man den Streichholz, entfernt den passenden Stopfen vom Erlenmeyerkolben und setzt zügig den großen Stopfen mit den verdrehten Stahldrähten locker auf. |
| Beobachtung: | Während der Stahldraht sich an der Luft mit einem Brenner nicht entzünden lässt, verbrennt der verdrehte Stahldraht in dem Kolben Funken sprühend wie eine Wunderkerze. |
| Deutung: | Die Schüler*innen können erkennen, dass hier nicht wie beim Vergleich der Brennbarkeit eines Eisennagels mit der von Eisenwolle der Zerteilungsgrad als Reaktionsbedingung von Bedeutung ist, sondern der hohe Anteil an Sauerstoff die heftige und vollständige Verbrennung der Stahldrähte bewirkt. |
Versuch 9: Ermittlung der aus Oxi-Produkten freizusetzenden Gasmengen (Kurzbeschreibung) |
Jeweils genau 0,5 Gramm eines Oxi-Produktes werden in ein Reagenzglas eingewogen, dieses mit einem durchbohrten Stopfen mit einem kurzen Glasrohr verschlossen und mit einem kurzen Stück Schlauch mit einem Kolbenprober verbunden. Dann erhitzt man das Oxi-Produkt so lange, bis sich das Volumen im Kolbenprober nicht mehr ändert. Nach dem Erkalten liest man das entstandene Gasvolumen ab.
Versuch 10: Ermittlung des Anteils an Sauerstoff im Gasgemisch |
| Geräte/Chemikalien: | 2 100-mL-Kolbenprober mit Hahn, Verbrennungsrohr, ∅ innen 6 mm, Länge 30 cm, kurze Schlauchstücke zur Verbindung von Kolbenprobern und Verbrennungsrohr, Reagenzglas 16 x 180 mm, passender durchbohrter Stopfen mit kurzem Glasrohr, ca. 30 cm langer Verbindungsschlauch passend zu einem Kolbenprober, kurzes gewinkeltes Glasrohr mit Rückschlagsicherung, Glaswolle, Oxi-Reiniger entsprechend Tabelle 1, Kupferoxid in Drahtform, Wasserstoff | |||||||||||||||
| Vorbereitung: | Das Verbrennungsrohr wird weitgehend und möglichst dicht mit dem Kupferoxid in Drahtform gefüllt und dieses an den beiden Enden mit Glaswolle gesichert. An die eine Seite schließt man eine Wasserstoffflasche und an die andere Seite das gewinkelte Glasrohr mit Rückschlagsicherung an. Dann lässt man Wasserstoff durch das Verbrennungsrohr strömen. Nach negativem Ausfall der Knallgasprobe am gewinkelten Glasrohr entzündet man dort den austretenden Wasserstoff und erhitzt dann das Kupferoxid mit einem Brenner so lange, bis es sichtbar und möglichst vollständig zu rosafarbenem Kupfer reduziert worden ist. Anschließend lässt man das Verbrennungsrohr im Wasserstoffstrom erkalten. Sollte keine Wasserstoffflasche vorhanden sein, kann alternativ auch Erdgas zur Reduktion verwendet werden, der Vorgang dauert dann allerdings etwas länger. |
|||||||||||||||
| Durchführung: | Dann füllt man das Reagenzglas etwa zu einem Drittel mit dem zu untersuchenden Oxi-Reiniger, verschließt es mit dem durchbohrten Stopfen und verbindet es über das ca. 30 cm lange Stückchen Schlauch mit einem Kolbenprober. Der Schlauch sollte nicht kürzer sein, da beim Zersetzen des Reinigers auch etwas Wasserdampf entsteht und dieser im Schlauch und nicht im Kolbenprober kondensieren soll. Dann erhitzt man den Reiniger mit einem Brenner und fängt das entstehende Gas in dem Kolbenprober auf. Die erste Füllung zu 100 mL wird verworfen, um möglichst sicher zu sein, dass die vorher im Reagenzglas enthaltene Luft verdrängt worden ist und nur das freigesetzte Gasgemisch aufgefangen wird. Nachdem der Kolbenprober das zweite Mal mit 100 mL Gas gefüllt worden ist, verschließt man ihn und verbindet ihn mit Hilfe kurzer Schlauchstücke mit dem Verbrennungsrohr und dem zweiten Kolbenprober. Nun öffnet man den Hahn am Kolbenprober mit der Gasprobe wieder, erhitzt die Kupferstäbchen mit einem Brenner und leitet das Gas mehrfach darüber. Dabei sollte die Position des Brenners mehrfach gewechselt werden. Wenn noch enthaltenes Kupfer nicht mehr oxidiert wird und das Gasvolumen konstant bleibt, ist die Reaktion beendet. Man lässt die Apparatur erkalten und liest das verbliebene Gasvolumen ab. Dieser Versuch wird mit allen zu untersuchenden Oxi-Reinigern wiederholt, dazu muss allerdings das Kupferoxid jeweils erst wieder reduziert werden. | |||||||||||||||
| Beobachtung: |
Je nach Schärfe des Erhitzens haben wir bei den von uns untersuchten Oxi-Reinigern aus 100 mL aufgefangenem Gas folgende Restvolumina und Anteile an Sauerstoff erhalten:
Tabelle 1: Ermittelte Anteile an Sauerstoff in 100 mL freigesetztem Gas |
|||||||||||||||
| Auswertung: | Die Schüler*innen können zum einen erkennen, dass offensichtlich nicht nur Sauerstoff als Gas freigesetzt wird. Zum anderen liefert zwar "Dalli Fleck Weg Oxi Power®" am meisten Gas. Dieses enthält aber nur etwa 60 - 68 % Sauerstoff und ist damit für Versuche, bei denen möglichst reiner Sauerstoff benötigt wird, offensichtlich nicht so geeignet. |
Versuch 11: Nachweis von Kohlenstoffdioxid in den Gasgemischen (Kurzbeschreibung) |
Man füllt ein Reagenzglas etwa zu einem Drittel mit dem zu untersuchenden Oxi-Reiniger, setzt einen durchbohrten Stopfen mit einem kleinen Glasrohr auf und verbindet dieses mit einem Stückchen Schlauch und einem Einleitungsrohr mit ausgezogener Spitze. Diese hält man in ein zweites Reagenzglas, in dem sich etwas Kalkwasser befindet. Nun erhitzt man die Reiniger und kann nach einiger Zeit eine leichte Trübung des Kalkwassers beobachten.
Versuch 12: Ermittlung des Anteils an Kohlenstoffdioxid in den Gasgemischen |
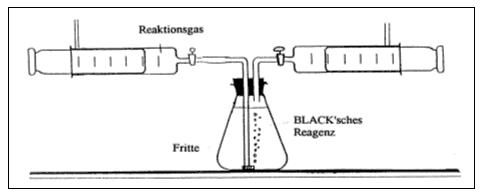
| Geräte/Chemikalien: | 2 100-mL-Kolbenprober mit Hahn, 1 250-ml-Erlenmeyerkolben, 1 passender Gummistopfen mit zwei Bohrungen, 1 Fritte, 1 gebogenes Glasrohr, kurze Schlauchstücke zur Verbindung von Kolbenprobern und Absorptionsapparatur, Reagenzglas 16 x 160 mm, passender durchbohrter Stopfen mit kurzem Glasrohr, ca. 30 cm langer Verbindungsschlauch passend zu einem Kolbenprober, Oxi-Reiniger entsprechend Tabelle 1, Kalilauge, w(KOH) = ca. 30% | |||||||||||||||
| Durchführung: |
Entsprechend Versuch 10 werden jeweils 100 ml der zu untersuchenden Gasproben aufgefangen, wobei auch hier darauf zu achten ist, die erste Füllung zu 100 mL zu verwerfen. Dann schließt man die beiden Kolbenprober (einer davon mit 100 mL der zu untersuchenden Gasprobe) entsprechend Abbildung 1 an den mit 30 %-iger Kalilauge (BLACK'sches Reagenz) weitgehend gefüllten Erlenmeyerkolben an und leitet das Gas durch die Kalilauge in den anderen Kolbenprober. Dann verschließt man die Hähne, tauscht die Kolbenprober um und leitet das Gas erneut durch die Kalilauge. Diesen Vorgang wiederholt man ein drittes Mal, dabei sollte sich das Gasvolumen nicht mehr ändern.
|
|||||||||||||||
| Beobachtung: |
Bei den von uns untersuchten Oxi-Reiniger haben wir aus 100 mL aufgefangenem Gas folgende Restvolumina und Anteile an Kohlenstoffdioxid erhalten:
Tabelle 2: Ermittelte Anteile an Kohlenstoffdioxid in 100 mL freigesetztem Gas |
|||||||||||||||
| Auswertung: |
Vergleicht man diese Werte mit denen aus Tabelle 1, so wird rasch deutlich, dass in den beim Erhitzen der Oxi-Reiniger freigesetzten Gasvolumina neben Sauerstoff und Kohlenstoffdioxid keine weiteren Gase in nennenswerten Mengen enthalten sein können. Gleichzeitig können die Schüler*innen erkennen, dass sich "Hoffmanns Vanish Oxi action®", "Heitmann O2-Energy®" und "Orange Glo Oxi Clean®" etwa vergleichbar gut für die vorgestellten Experimente eignen, während bei "Dalli Fleck Weg Oxi Power®" im Gasgemisch weniger Sauerstoff und mehr Kohlenstoffdioxid enthalten ist. |
Literatur |
[1] www.chemie-baumbach.de, Versuchsanleitungen, Untersuchung der Reaktion verschiedener Alkane mit reinem Sauerstoff