« zurück zur Übersicht - Projektarbeiten
"Mikroskopie: Rheinbergbeleuchtung / Darstellung von Acetylsalicylsäure Kristallen"
von Angela Jelic, Andrea Kunz und Susanne Leicht (Schuljahr 2004/05)
| Aufgabenstellung | zum Seitenanfang  |
Theoretischer Teil: Reinbergbeleuchtung.
Praktischer Teil: Darstellen von Acetylsalicylsäure Kristallen
Unsere Aufgabe bestand darin, die Kristalle der Acetylsalicylsäure unter Einwirkung von polarisiertem Licht unter einem Mikroskop darzustellen und das Wachstum der Kristalle mittels einer Digitalkamera zu filmen.
| Grundlagen der Mikroskopie | zum Seitenanfang  |
| 1. Aufbau eines Mikroskops | zum Seitenanfang  |
| 1. Okular: | Projiziert Mikroskopzwischenbild auf die Netzhaut der Augen. Es vergrößert das Zwischenbild vom Objektiv. Schnittstelle des Mikroskops. Erfüllt die Funktion einer Lupe und besteht aus einfachen Linsen. |
| 2. Tubus: | Enthält spezielle Prismen die das Bild teilen und es als Zwischenbild dem Okular zur Verfügung stellt. |
| 3. Ringschwalbe: | Ermöglicht schnellen Wechsel des Tubus bis um 360°, für einen besseren Einblick. |
| 4. Stativ: | Träger aller Komponenten. Hauptbestandteil sind Arm und Fuß. |
| 5. Revolver und Objektiv: | Speziell genormte Bohrungen mit Innengewinde zur Aufnahme der Objektive, erlauben das Einschwenken des gewünschten Objektives. Es gibt 4 und mehr Objektive unterschiedlicher Vergrößerung im Revolver. Objektiv entwirft das mikroskopische Zwischenbild. |
| 6. Objekttisch: | Der Objekttisch besteht aus einer viereckigen Platte mit einem Loch oder Schlitz um das Objekt zu durchleuchten. Der Objektträger wird entweder mit Objektklemmen oder einem Kreuztisch fixiert. Der Kreuztisch ermöglicht durch den Kreuztischtrieb eine genaue Führung des Objektträgers. |
| 7. Kondensor: | Neben Okular, Objektiv und Prismen die vierte Mikroskopkomponente. Ohne den Kondensor wäre das Köhlersche Beleuchtungsprinzip nicht realisierbar. |
| 8. Kondensortrieb: | Ermöglicht feinfühliges Heben und Senken des Kondensors. |
| 9. Grob- und Feintrieb: | Mit ihm verstellt man entweder Objekttisch oder Tubus, je nach Mikroskop, in der Höhe. Er reguliert die Schärfe eines Bildes durch heben oder senken des Tisches. Bei manchen Mikroskopen sitzt der Knopf für den Feintrieb auf dem Grobtrieb. |
| 10. Leuchtfeldblende: | Bei größeren Labormikroskopen, für die Einstellung der Köhlersche Beleuchtung nötig. |
| 11. Beleuchtung: | Eine Lichtquelle welche von unten einen Strahl durch den Kondensor in das Objekt und durch diesen hindurch im Objektiv und Okular das Bild projiziert. |
| 12. Blendenzentrierung: | Dient der Zentrierung der Blende. |
| 13. Mattglasscheibe: | Dient der Lichtstreuung. Sie ermöglicht eine gleichmäßige Lichtverteilung der Farbsäule. |
| 1-1. Linse | zum Seitenanfang  |
Es gibt zwei verschiedene Arten von Linsen: Sammellinsen und Zerstreuungslinsen.
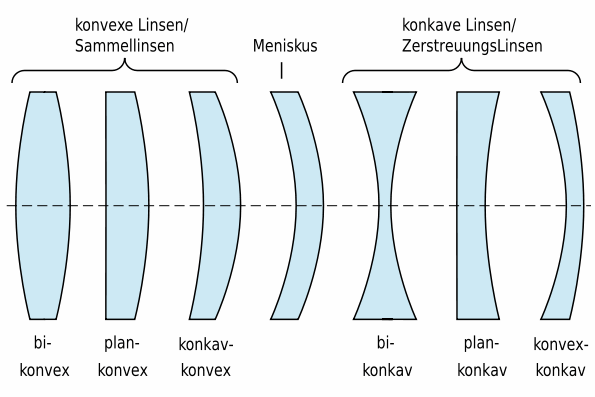
Abb. 2 Linsenarten © Fabian Emmes
Quelle: http://de.wikipedia.org/wiki/Bild:Linsenarten.svg
| 1-2. Strahlengang | zum Seitenanfang  |
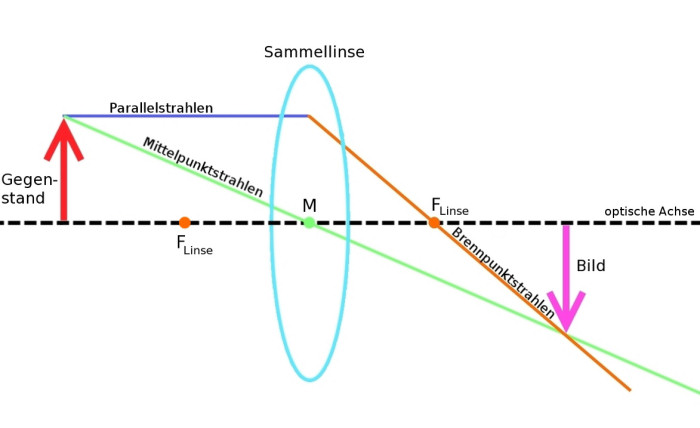
Abb. 3 Bildentstehung Sammellinse © Patrick Klitzke
Quelle: http://de.wikipedia.org/wiki/Bild:Bildentstehung_Sammellinse.jpg
| 1-3. Möglichkeiten der Beleuchtung | zum Seitenanfang  |
Im Wesentlichen kommt der Mikroskopiebeleuchtung die Aufgabe zu, das zu untersuchende Objekt richtig zu beleuchten. Man hat sich häufig darüber gestritten welche die richtige Beleuchtungsmethode sei.
Die Köhlersche Beleuchtung ist die interessanteste und für Hellfeldmikroskopie die effektivste.
Köhlersche Beleuchtung:
Professor August Köhler (1866-1948) veröffentlichte 1893 die Regeln für optimale Lichtführung im Mikroskop.
Bei einer Köhlerschen Beleuchtung wird bei maximaler Lichtausbeute eine homogene Ausleuchtung des Präparates erreicht. Außerdem wird die Entstehung von Streu- und Falschlicht minimiert, die den Kontrast mindern würden.
Das Streu- und Falschlicht entsteht durch Streuung des Mikroskopierlichtes an Strukturen des Präparates. Außerdem kann es durch das optische System des Mikroskops zu Reflexionen kommen.
Um dies zu beheben dürfte nur der zu untersuchende Teil ausgeleuchtet werden, z.B. mit einer Blende. Allerdings ist der zu untersuchende Teil meist sehr klein und somit ist es nicht gut möglich eine blende einzusetzen, da diese sehr klein und im Präparat sein müsste.
Köhler löste das Problem indem er das Bild einer Blende in die Präparateebene brachte. Dies ist möglich wenn die Leuchtfeldblende zwischen Lichtquelle und Kondesor in den Strahlengang gebracht wird.
Kritische Beleuchtung:
Die Kritische oder Nelson Beleuchtung ist ein einfaches aber effizientes Verfahren. Für Anfänger am geeignetsten. Das Prinzip beruht darauf, dass eine gleichmäßige beleuchtete Mattscheibe in die Objektebene projiziert wird.
Voraussetzung:
Eine Mattglasscheibe muss zwischen Lampe und Kollektor gebracht werden. Kondensor muss höhenverstellbar sein.
Gegenüberstellung der Köhler- und Nelson-Beleuchtung
Köhler Beleuchtung
- aufwendig
- Neueinstellung bei jedem Objektivwechsel
- man verliert das Präparat leicht aus den Augen
Nelson Beleuchtung
- schneller, da nach Objektivwechsel nur der Kondensor gehoben oder gesenkt werden muss
- dadurch wird das betrachtete Objekt nicht aus den Augen verloren
Schiefe Beleuchtung:
Wie das Wort schon sagt, stellt sich die Beleuchtung schief, also von der Seite dar.
Das Licht wird von einem Lichtundurchlässigen Hindernis welches sich im Strahlengang befindet zur Seite hin abgelenkt.
Dieses "schiefe" Licht trifft das Objekt nun in der Hauptsache von der Seite, statt von unten.
Dadurch wird der Kontrast im Objekt verstärkt, so dass auch feinste Einzelheiten besser dargestellt werden können.
Die Einstellungen sind die Selben wie bei der Köhlerschen Beleuchtung, nur dass hier noch ein Hindernis in den Strahlengang eingebaut wird.
Quellen:
- www.mikroskopie.de
- www.mikroskopie-fuer-anfaenger.de
| 2. Methoden der Kontrastverstärkung | zum Seitenanfang  |
| 2-1. Dunkelfeldmikroskopie | zum Seitenanfang  |
Die Dunkelfeldmikroskopie ist ein mikroskopisches Spezialverfahren, bei dem die Objekte hell vor dunklem Hintergrund erscheinen, um einen höheren Kontrast zu erzielen, welcher bei der Hellmikroskopie nicht erlangt werden kann.
Die Dunkelfeldmikroskopie ist im Gegensatz zur klassischen quantitativen Hellmikroskopie eine qualitative Betrachtung des Objektes.
| 2-2. Die Dunkelfeldbeleuchtung | zum Seitenanfang  |
Dazu ist es notwendig das entsprechende Objekt nur mit einem Streiflicht zu beleuchten. Dieses Streiflicht entsteht aus dem Vorgang, dass der Lichtstrahl, welcher aus dem Ring des Filters an den Kondensor durchgelassen wurde, das Objekt trifft und die dadurch entstandene Brechung auf die Objektlinse abgebildet wird und die ungebrochenen Lichtstrahlen an der Objektlinse vorbeistrahlen, was mit dem schwarzen Untergrund einen sehr starken Kontrast ergibt. Somit wird dem zu untersuchenden Objekt die Farbe des Ringes gegeben und der Untergrund erscheint in der Mittelkreisfarbe des Filters schwarz.
Die Dunkelfeldmikroskopie wird vor allem in der Medizin verwendet
- besonders zur Blutuntersuchung
- aber auch in der Umwelttechnik, zum Beispiel für die Charakterisierung von faserförmigen Luftverunreinigungen
- in der Physik, zum Beispiel zur Strukturbreitmessung
Bei der Dunkelfeldmikroskopie gibt es auch die Möglichkeit mit einem spezial Kondensor(Bild) zu arbeiten, dessen Apertur so groß ist, dass die direkt aus ihm kommenden Lichtstrahlen am Objektiv vorbei gehen. Nur wenn ein Präparat in die Strahlung gebracht wird, gelangt das von ihm gebeugte oder gebrochene Licht in das Objektiv und trägt zur Abbildung bei, wo dann die Struktur hellleuchtend vor dunklem Hintergrund erscheint. Da der Spezielkondensor (Dunkelfeldkondensor) sehr teuer ist, wird das Verfahren mit dem Ringfilter (siehe oben) eher benutzt aufgrund seiner Einfachheit, es mit einem normalen Kondensor zu kombinieren.
| 2-3. Reinbergbeleuchtung | zum Seitenanfang  |
Immer bemüht seine Objekte so kontrastreich wie möglich zu sehen, kamen viele Mikroskopiker auf die Idee das durchstrahlende Licht mittels Farbfilter zu manipulieren. Vor ca. 100 Jahren demonstrierte der britische Mikroskopiker Julius Reinberg erstmals vor der Royal Microscopical Society und dem Quekett Club eine Form das Präparat optisch einzufärben. Diese Technik ist eine auffallende Veränderung, die damals mittels farbiger Gelatine oder Glasfiltern das Objekt und den Hintergrund in reichen Farben darstellte. Die Rheinbergtechnik kann mit der ähnlichen Dunkelfeldbeleuchtung verglichen werden.
Technisch wird dieses Verfahren realisiert, indem das direkte Beobachtungslicht, der zuerkennende Untergrund, nicht wie bei der Dunkelfeldmikroskopie vollständig ausgeblendet wird, sondern durch einen Farbfilter ersetzt wird. Hierzu wird das entsprechende Filtermaterial in den Filterhalter unterhalb des Kondensors gelegt. Durch diese Kontrastbeleuchtung nach Rheinberg lassen sich die Konturen eines Objekts stark betonen und noch deutlicher hervorheben.
In den Beispielbildern lässt sich sehr gut erkennen, dass bei der Hellfeldmikroskopie (a) das Objekt eine relativ unscharfe Abbildung der Konturen aufweist, welche bei der Dunkelfeldmikroskopie (b) deutlich schärfer zu erkennen sind. Ebenso bei der Rheinbergabbildung (c) durch das kontrastreiche Farbspiel von einem blauen Hintergrund und einer gelben Bestrahlung des Objekts wird das Objekt detaillierter zum Vorschein gebracht, jedoch ist es durch die Wahl des blauen Hintergrundes merklich angenehmer zu betrachten und nebenbei bietet es einem einen ästhetisch wunderschönen Anblick des Objekts. Diese Tatsache hat auch in anderen Bereichen des Mikroskopierens viele Erforschungsmöglichkeiten eröffnet und den Liebhabern der Mikroskopie einen neuen Horizont, die Mikrografie, eröffnet.
So werden zum Beispiel Rheinbergabbildungen dazu verwendet um Fasern, Urtierchen (Einzeller), Gewebe, Insekten, Holzschnitte, Kristalle und andere farblose kontrastarme Gegenstände zu untersuchen.

Taubenschwänzchenflügel unter Rheinbergbeleuchtung

Stubenfliegenflügel unter Rheinbergbeleuchtung
2.3.1 Herstellung eines Rheinbergfilters
Wie oben im Text erwähnt bestanden die früheren Farbfilter zur kontrastreichen Rheinbergbeleuchtung aus Gelatine oder Glasfiltern. Heute lassen sich diese Farbfilter mit Hilfe der Computertechnik ganz schnell und einfach selbst konstruieren. Durch diese Methode lassen sich die Farbfilter schnell verändern oder nacharbeiten, falls notwendig. Mittels des Internets lassen sich Bildbeispiele herunterladen. Unter zu Hilfenahme eines Bildbearbeitungsprogrammes lassen sich dann diese Filter auf die passende Größe zurecht formatieren, je nach Modelvorgabe des eigens verwendeten Mikroskops, sowie die farbliche Zusammensetzung der Farbringe individuell variieren. Nun druckt man mit einem Tintenstrahldrucker die Farbringe mit höchst möglicher Farbqualität (dpi) auf eine Folie, die einerseits sehr preiswert ist, aber zugleich eine intensivere Ablichtung des Objekts auf dem Mikroskop ermöglicht, aus. Ebenfalls lassen sich die Ringe mit unterschiedlichen Farben aus Papierringen oder leichtem Metall herstellen. Bei jeder Praktik ist jedoch darauf zu achten, dass die Abmessung der Zentralblende eines jeden Mikroskops mit der der Farbringe gleich ist. Somit ist die Anpassung an jedes Mikroskop mit Papier, Pappe oder ähnlichen Materialien leicht gegeben, da diese schnell durch entsprechendes zuschneiden angefertigt werden können. Ein Beispiel hierfür bietet einem die Internetseite von Wim van Edmund dessen Webadresse unter den Quellen zu finden ist. Eine weitere Möglichkeit sich selber einen Rheinbergfilter herzustellen ist eine sehr einfache Methode. Hierzu wird lediglich die Folie als Trägermaterial verwendet und mit Filzstiften die Kreise und Ringe in der entsprechenden Farbe aufgemalt und der geforderten Größe des Mikroskops ausgeschnitten.
Die genaue Anwendung beruht darauf, dass die helle sich gut gegen den dunkleren Hintergrund abbildende Objektfarbe durch eine andere Farbe ersetzt wird. Man hat also die schwarze Mittelscheibe (Dunkelfeld) durch eine andersfarbige (z.B. blau, grün, rot oder ähnliche) und den die Scheibe umgehenden Ring durch einen ebenfalls farbigen Ring (gelb, orange oder ähnliches) ersetzt. Durch diesen Effekt wurde die Hintergrundfarbe verändert und das Objekt wurde vom seitlichen andersfarbenen Licht durchstrahlt. Alleine diese einfach dargestellten Farbunterschiede fördern schon die sehr schöne und kontrastreiche Abbildung gegen den andersfarbigen Hintergrund.
Quellen:
- http://pluslucis.univie.ac.at/FBA/FBA00/vasak/k2.pdf
- http://mikroskopie-für-anfänger.de
- http://www.microscopy-uk.org.uk/mag/artnov02/diydic.html
| 2-4. Polarisation | zum Seitenanfang  |
Der Entdecker der Polarisation des Lichtes ist E.L. Malus, der 1811 mit seinem Polarisationsapparat biologische Objekte betrachtete. Das erste Polarisationsmikroskop entwickelte B.G. Amici um 1830, mit einem Glasplattensatz und einem Kalkspatkristall als Polarisator.
Polarisiertes Licht wird zum Beispiel in der Fotographie benutzt oder bei qualitativen- und quantitativen Untersuchungen in der physikalischen Chemie (z.B. beim Polarimeter).
Bei der Polarisation dreht es sich nicht um eine Vergrößerung eines Objekts, sondern um das Sichtbar machen der optischen Eigenschaften der zu untersuchenden Substanz.
Kann ein Stoff die Schwingungsebene des polarisierten Lichts drehen, spricht man ihm eine optische Aktivität zu.
Dies kann man erzielen durch:
- Absorption (Polarisationsfilter)
- Doppelbrechung mit anschließender Totalreflexion (Nicolsches Prisma)
- Reflexion
- Streuung
Um das Licht mit den Polarisationsfiltern zu polarisieren baut man ersten Pol-Filter (Polarisator) unter dem Kondensor ein, den zweiten Pol-Filter (Analysator), zwischen das Objektiv und dem Okular oder genau auf das Okular.
Licht bildet Transversalwellen (Querwellen) aus; das bedeutet, die Wellen verlaufen senkrecht zur Fortpflanzungsrichtung des Ausbreitungsmediums, hier das Licht. Andere Beispiele für Transversalwellen sind Seil-, oder Wasserwellen.
Weißes Licht besteht aus vielen verschiedenen Farben, das heißt, es ist polychromatisch.
Trifft weißes Licht auf ein Prisma, so wird das Licht in seine Spektralfarben zerlegt, die in unterschiedlichen Lichtwellenlängen schwingen.
Geht das Licht nun durch den ersten Pol-Filter wird das Licht in 2 polarisierte Lichtstrahlen zerlegt, den ordentlichen und außerordentlichen Strahl. Diese beiden Strahlen befinden sich in ihrer Schwingungsrichtung senkrecht aufeinander.
Verdreht man die Filter, dass sie in der parallelen Ebene senkrecht im 90º Winkel zueinander stehen wird das polarisierte Licht komplett ausgelöscht. Die Filter befinden sich in der Kreuz-, oder Dunkelstellung. Es geht kein Licht mehr durch.
Für die Polarisationsmikroskopie dreht man die Filter, bis einer der beiden Strahlen ausgeschaltet wird. Der andere Strahl wird für die Mikroskopie genutzt.
Befindet sich zwischen den Filtern ein Objekt mit eigenen Polarisationseigenschaften, die selbst doppelbrechend wirken, entstehen Aufhellungen und das Präparat erscheint in verschiedenen Farben. Je nach drehen der Filter entstehen verschiedene Effekte.
Solche Objekte können biologische Strukturen sein wie Muskelfasern, Bindegewebe, Sehnen, Knochengewebe, Kartoffelstärke oder anisotropische Substanzen wie viele Kristalle.
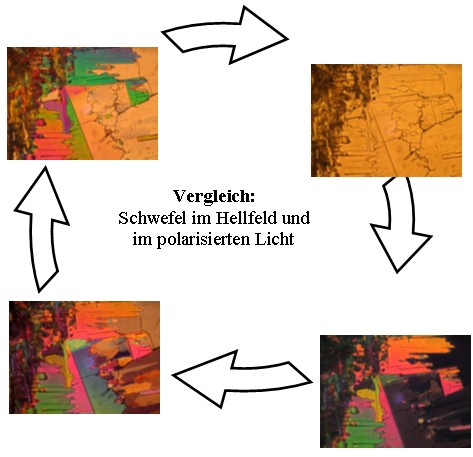
Schwefel im polarisierten Licht:
 |
Ohne Polarisationsfilter |
 |
Drehung des Filters um: 0° |
 |
Drehung des Filters um: 90° |
 |
Drehung des Filters um: 180° |
 |
Drehung des Filters um: 270° |
| 3. Grundlagen der Kristallisation | zum Seitenanfang  |
Kristalle wurden als erstes in Griechenland entdeckt. Das Wort Kristall stammt von dem griechischen Wort "kryos" ab, was soviel wie Eis bedeutet. Im antiken Griechenland fand man im dort betriebenen Bergbau wahrscheinlich Quarzkristalle, die man für nicht geschmolzenes Eis hielt. Deshalb der Name "Krystall" der sich mit der Zeit zu "Kristall" wandelte.
(Susanne Leicht)
| 3-1. Woher weiß man wie das Gitter eines Kristalls aussieht | zum Seitenanfang  |
Alles geht auf den Wissenschaftler Max von Laue zurück der 1914 den Nobelpreis für das Verfahren der Röntgenstrukturanalyse gewonnen hat. Mit Hilfe der kurzwelligen Röntgenstrahlen war ihm ein Blick in das Gitter möglich. Durch die Bausteine des Gitters, also Ionen und Moleküle, wird diese Strahlung gebeugt.
Man dreht den Kristall so lange, bis durch das monochromatische Licht mit einer bekannten Wellenlänge, das auf den Kristall geschickt wird, eine Beugung auftritt. Auf einem Monitor erscheint ein Beugungsbild. Hier raus kann nun der dazugehörige Winkel gemessen werden.
Man kann die Geometrie der Elementarzelle also berechnen, wenn man die Wellenlänge kennt und den Winkel bei der die Beugung aufgetreten ist.
(Susanne Leicht)
3.1.1 Geometrie eines Kristalls
Wie ein Kristall strukturell aufgebaut ist, erkennt man immer an der Elementarzelle.
Eine Elementarzelle ist die kleinste Einheit in einem Kristall, welche alle Eigenschaften des Kristalls wiederspiegelt. Diese kleinste Einheit kann niemals rund aufgebaut sein, sondern immer so, dass die Zellen lückenlos aneinander gereiht werden können. Die Elementarzelle gibt auch an, in welcher Form der Kristall vorliegt, also zum Beispiel rhombisch oder monoklin. Dies variiert aber auch von der Art der Bindung, welche Form ein Kristall aufweist. Ein Kristall setzt sich aus vielen Elementarzellen zusammen, allerdings gibt es immer in Kristallen sogenannte Fehlstellen, die zum Teil auch für die elektrische Leitfähigkeit verantwortlich sind. Eine Fehlstelle ist ein Abbruch der regulären Anordnung des Kristalls, dass heißt, dass da wo eigentlich ein Ion liegen sollte, nichts liegt.
Es gibt 7 Möglichkeiten des Aufbaus: triklin, monoklin, orthorombisch, tetragonal, rhomboedrisch, hexagonal und kubisch.
Nun gibt es aber nicht nur eine Form von Gittertypen, sondern im Grundzug 4 Stück. Diese werden im Folgenden vorgestellt.
(Andrea Kunz)
3.1.2 Ionengitter und Ionenbindung
Ionengitter bestehen aus positiv und negativ geladenen Teilchen. Nach außen ist das Ionengitter aber elektrisch neutral, was man damit begründen kann, dass sich die Ionen so zusammenlagern, dass sie eine minimale potentielle Energie besitzen. Der Kontakt zwischen zwei entgegengesetzt geladenen Teilchen wird vermieden. Um ein positiv geladenes Ion werden also so viele negativ geladene Ionen gepackt wie es nur möglich ist. Die Ionen werden durch elektrostatische Wechselwirkungen, die Coulombschen Kräfte, zusammengehalten. Dadurch, dass diese Kräfte ungerichtet sind aber sehr effektiv, haben Salze einen hohen Schmelzpunkt.
Ein Atom kann nicht von selbst ein Ion werden und dadurch in den Edelgaszustand gelangen. Dazu muss es entweder Elektronen abgeben oder aufnehmen und mit Atomen in Wechselwirkung treten, die diese Elektronen aufnehmen können. Es müssen also elektropositive und elektronegative Elemente miteinander reagieren.
Nehmen wir das Beispiel des Natrium und des Chloridiones. Beide Elemente möchten den Edelgaszustand erreichen, also eine voll besetzte Schale haben. Dadurch wird das Natriumatom sein Valenzelektron an das Chloratom abgeben. Es kommt zu einer elektrostatischen Anziehung der entgegengesetzten Ladungen beider Ionenarten und somit zu einer chemischen Bindung.
Bleiben wir bei dem Beispiel des NaCl. Bei näherer Betrachtung kann man erkennen, dass das Na+-Ion von 6Cl-Ionen gleicher Entfernung umgeben ist und umgekehrt das gleiche. Somit haben Cl- und Na+ die Koordinationszahl 6.
Um sich jetzt den Aufbau von Na+ und eines Cl- zu veranschaulichen, kann man sich folgendes vorstellen. 1mol Na+ und 1mol Cl- sollen zusammengebracht werden. Jedes Ion wird starke elektrostatische Anziehungskräfte auf das jeweils andere Ion ausüben, dies lässt sich so erklären, dass das elektrische Feld eines Ions kugelförmig ist, also alle elektrostatischen Kräfte eines Ions wirken gleichmäßig in alle Richtungen des Raums. Deswegen kommt es zu einer regelmäßigen Anordnung der Ionen. Dadurch entsteht ein sichtbarer Körper, also ein Ionenkristall. Jedoch bestehen in so einem Ionenkristall, weder in gelöster noch in geschmolzener Form, zwischen den Ionen gerichtete Bindungen.
Eine weitere Eigenschaft der Ionenkristalle ist, dass sie sehr spröde sind. Übt man einen größeren Widerstand auf den Kristall aus, verschieben sich die Ionenschichten, kommen jetzt gleiche Ladungen miteinander in Berührung so zerbricht der Kristall.
Im Kristallgitter können die Ionen nicht einfach ihre Plätze tauschen, deshalb können die festen salzartigen Verbindungen im Gegensatz zu ihren Schmelzen und ihren Lösungen den elektrischen Strom nicht leiten.
Die Na+ und Cl- Ionen werden in einem kubischen (würfelartigen) Gittersystem angeordnet. Die würfelförmige Elementarzelle besteht aus 27 Ionen. Jedes Ione ist von 6 Gegenionen umgeben, diese sind oktaedrisch angeordnet.
(Susanne Leicht)
3.1.3 Das Molekülgitter und sein Molekül
Der Molekülbegriff:
Dadurch, dass Atome selten selbständig auftreten können und unbeeinflusst von anderen Atomen sind, sind die Atome in diskrete Atomgruppen eingegliedert, die man Moleküle nennt. Es gibt zwei verschiedene Arten von Atomzusammenschlüssen.
- Zusammenschluss von Atomen einer einzigen Atomart zu Elementmolekülen
- Zusammenschluss von mindestens 2 Atomen verschiedener Atomart zu Verbindungsmolekülen
Nichtmetalle liegen in elementarer Form in Molekülen vor (keine Edelgase). Da zwischen den Molekülen nur geringe Kräfte (Van der Waals Kräfte) herrschen, sind diese Stoffe bei Raumtemperatur gasförmig und bei höheren Atommassen bzw. größeren Molekülen flüssig oder fest, jedoch einen niedrigen Siedepunkt besitzen. Feste Nichtmetalle bilden Molekülgitter wie zum Beispiel der Schwefel oder der Phosphor.
Die Bausteine des Molekülgitters sind natürlich Moleküle, diese werden durch schwache intermolekulare Anziehungskräfte zusammengehalten. Entweder durch Van der Waals Kräfte oder durch sogenannte Dipol-Dipol Kräfte.
Die Kristalle der Molekülgitter sind größtenteils alle leicht löslich.
Wichtig zu erwähnen sind die Molekülgitter, die durch Wasserstoffbrückenbindungen zusammengehalten werden. Wie zum Beispiel die Zitronensäure, die Weinsäure oder einfach Wasser das als Eis Kristalle bildet. Diese Strukturen bilden sehr harte Kristalle.
Auch gibt es noch Molekülgitter die durch zwei Bindungskräfte gleichzeitig zusammengehalten werden, wie die von Fettsäuren und Stearinsäuren. Die erste Bindungskraft wirkt zwischen den unpolaren Kohlenwasserstoffen, die van der Waals Kräfte und die zweite Bindungskraft wirkt zwischen den polaren Carboxylgruppen, die Wasserstoffbrücken.
(Susanne Leicht)
3.1.4 Metallgitter
Die Gitterbausteine eines Atomgitters bilden Atome, die durch kovalente Bindungen mit einander verbunden sind. Diese Systeme nennt man auch Valenzgitter, da die Bindung mit Hilfe der Valenzelektronen zu Stande kommt. Allerdings ist der Begriff Atomgitter in verschiedenen Literaturausgaben nicht wieder zu finden, da dieser oft auch verwirrend ist. Meist spricht man in diesem Fall von gerichteten Kovalenzbindungen. (Der S8- Ring z.B. ist kein kovalentes Netzwerk, da es Moleküle bildet und somit zu den Molekülgittern zählt.)
Diese Art von Gitter bildet sich immer zwischen Elementen ähnlicher Elektronegativität aus, ein Idealfall wäre die Ausrichtung Atome mit gleicher EN, sprich zwischen den jeweiligen Elementen selbst, z.B. die verschiedenen Kohlenstoffanordnungen Graphit, Diamant und Fulleren.
Die Beschreibung dieser Verbindungsart basiert auf der VB- oder der MO-Theorie.
Beispiele: Kohlenstoffmodifikationen wie der Diamant oder der Graphit oder Quarz (SiO).
Die Vernetzungen untereinander könne verschiedene Formen aufweisen:
- Eindimensionale Ketten- oder Bandgitter, d.h. sie bilden lange Molekülketten (Beispiel: eine Art von SiO)
- Zweidimensionale Schichtgitter, d.h. großflächige Schichten aus untereinander verbundenen Atomen (Beispiel: Graphit)
- Dreidimensionale Gerüstgitter (Beispiel: Quarz, Diamant)
Die Gitterstruktur hat Einfluss auf die Eigenschaften, d.h. je nach Struktur können zum Beispiel andere Schmelzpunkte vorliegen.
Auch die Härte variiert unter den verschiedenen Strukturen; so sind zweidimensional Schichtgitter recht weich, da diese verschoben werden könne, dreidimensionale Schichtgitter hingegen sind relativ hart.
Zweidimensionale Schichtgitter sind oft auch flächig oder faserig ausgebildet, dreidimensionale Schichtgitter hingegen bilden voluminöse Gitter.
(Andrea Kunz)
3.1.5 Metallgitter
Ein Metallgitter wird dann gebildet, wenn jedes Metallatom je nach Wertigkeit ein oder mehrere Valenzelektronen dem Gesamtgitter zu Verfügung stellt und selbst zu einem Kation (= Metallatomrumpf) wird. Die Valenzelektronen gehören nun allen Metallatomrümpfen gemeinsam und verteilen sich so als delokalisierte Elektronen über das Gesamtgitter und bilden somit das sog. Elektronengas. Dieses Elektronengas bewirkt den Zusammenhalt eines Metallgitters und ist der Grund, weshalb ein Metall leitfähig ist.
Die Modellvorstellung basiert auf der MO- Theorie, wobei das Metallgitter als Riesenmolekül betrachtet wird und der Aufbau Schritt für Schritt aus einzelnen Atomen vonstatten geht. Dies beschreibt das sogenannte Energieband.
Die Koordinationszahl liegt bei Metallen zwischen 8 und 12. Bei KZ 8 liegt ein kubisch raumzentriertes Gitter vor; ein Beispiel für diese Form wäre zum Beispiel Wolfram.
Bei einer KZ von 12 liegt eine kubisch dichteste Kugelpackung vor, ein Beispiel für dieses Modell wäre zum Beispiel Kupfer.
Eine KZ von 12 liegt auch vor, wenn eine hexagonal- dichteste Kugelpackung vorliegt. Hierzu wäre ein Beispiel Magnesium oder Zink.
Seine Eigenschaften verdankt ein Metall seinem besonderem Aufbau. So sind Metalle dank dem Elektronengas besonders gut elektrisch und thermisch leitfähig: Bei der Anlegung einer Spannung, bewegen sich die Elektronen aus dem Elektronengas in eine Richtung und ersetzen dadurch das vorherige Elektron. Auch der metallische Glanz wird durch das Elektronengas hervorgerufen: die Elektronen aus der Elektronenwolke absorbieren jede Wellenlänge und geben diese wieder frei.
Der meist hohe Schmelzpunkt eines Metalls kommt durch die allseitig gerichteten Bindungskräfte zu Stande. Auch seine Duktilität, d.h. seine gute Verformbarkeit, verdankt ein Metall seinem Aufbau, denn diese ruft die Gleichartigkeit der Gitterbausteine eines Metalls hervor. Eine Ausnahme bildet hierbei Quecksilber, da dieses bei Raumtemperatur bereits flüssig ist.
(Andrea Kunz)
| 3-2. Kristallwachstum | zum Seitenanfang  |
Unter Kristallwachstum versteht man das kontinuierliche Größerwerden eines Keims bis zum fertigen Kristall. Grundsätzlich besteht der Kristallisationsprozess aus zwei Teilschritten, der Keimbildung und dem Kristallwachstum.
Durch die Kristallisation können morphologische Stoffeigenschaften gezielt verändert werden. Die Kristallisation lässt sich aber auch zur Reinigung, Stofftrennung und Aufkonzentrierung einsetzen.
Es gibt verschiedene Methoden Kristalle zu züchten unter anderem aus der flüssigen Phase, aus der Schmelze, Gasphase oder über übersättigen von Lösungen oder durch Einhängen eines Impfkristalles. Die jeweiligen chemischen Substanzen scheiden einen Keim als Festkörper aus. Die Größe des Keimes beträgt ca. 100 Angström = 0,00001mm (10 -5mm). An ihn lagern sich weitere Kristallbausteine an (Atome, Ionen, Kationen oder Moleküle). Der Kristall wächst somit weiter durch gerichtete Anlagerung, indem sich das Grundmuster ständig wiederholt.
Versuche zu den beschriebenen Methoden:
Übersättigen von Lösungen:
- Kupfersulfatkristalle entstehen beim Abkühlen der Lösung
- Rote Blutaugenkristalle entstehen beim Verdunsten von Kaliumhexacyanoferrat(III). Diese Methode sollte am besten funktionieren wenn man das Präparat in den Kühlschrank stellt.
- Mit dem Versuch des Bleibaumes kann man die Unterkühlte Schmelze am besten Darstellen, da dieser Vorgang auf der Reduktion von Blei-Ionen durch Zink beruht. Diese exotherme Reaktion läuft sehr schnell ab.
Ziele der Kristallisation ist fast immer gleichförmige, sphärische Kristalle zu erzeugen. Ungleichförmige Partikel, da der Einbau von Atomen nicht immer gleichmäßig abläuft, können durch Umkristallisation in eben solche Kristalle umgewandelt werden. In vielen Fällen bedeutet dieses ein verbessertes physikalisches Verhalten also hat bessere Eigenschaften und lässt sich so besser verwenden.
Ein weiteres Ziel ist die Herstellung möglichst fehlerarmer Kristalle, dies ist notwendig um z.B. eine höhere Unempfindlichkeit bei mechanischer Beanspruchung zu erreichen.
Die Wachstumsgeschwindigkeit einer Fläche hängt relativ von der Größe der anderen Flächen ab. Dies führt dazu das gewisse Flächen im Laufe des Wachstums verkümmern oder ganz verschwinden. Flächenarme Kristalle zeugen daher auch von einer langen Bildungsdauer.
Hängt man z.B. eine aus Steinsalz (= Mineral Halit) geschliffene Kugel in eine gesättigte Kochsalzlösung, bildet sich bald wieder ein Körper mit mit Kanten, Ecken und ebenen Flächen. (Versuche in denen ein Impfkristall in die übersättigte Lösung gehängt wird an dem sich die Atome absetzen und den Kristall bilden).
Während des Wachstumsstillstandes können sich jedoch auch Fremdkörperchen (z.B. Flüssigkeiten, Fremdmineralien, etc) die sich an den Kristallfächen ablagern und als Einschlüsse im Kristall bleiben (Kristalle können sich dadurch ihre gleichmäßige Form verlieren).
Meist behindern sich die Kristalle gegenseitig am Wachstumsprozess, so dass kein idiomorpher "Bilderbuch"- Einzelkristall entsteht sondern ein sog. Aggregat (z.B. nadelige, rosettenförmige, niedrige oder traubige Aggregate. Schön erkennbar am vorher beschriebenen Bleibaum-Versuch, da sich die Nadeln entwickeln sog. Skelettkristalle). Die Liste an Aggregat-Formen aber auch an Kristallformen könnte man noch beliebig fortsetzen es sind allerdings zu viele um sie hier alle aufzuführen.
| Praktischer Teil: Darstellen von Acetylsalicylsäure Kristallen | zum Seitenanfang  |
Unsere praktische Aufgabe im Labor war es Acetylsalicylsäure unter dem Mikroskop auskristallisieren zu lassen. Wir haben uns zunächst einige Kristalle im polarisierten Licht betrachtet. Die folgenden Bilder zeigen, wie unter dem polarisierten Licht die Kristalle durch den dunklen Hintergrund in einem frohen und wunderschönen Farbzusammenspiel hervorgehoben werden.
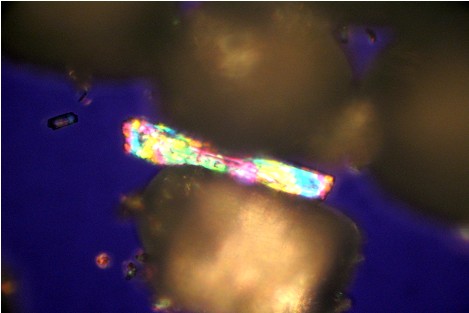
Kristall unter polarisiertem Licht
Dieses Foto zeigt einen Kristall, der sich in seiner Größe deutlich von den anderen unterscheidet. Aufgrund seiner winzig kleinen Beschaffenheit hebt sich dieser Kristall von den anderen ab und gibt dieses sehr schön ansehendliche Bild ab.
Die zwei folgenden Aufnahmen zeigen wieder ein Kristall unter dem Mikroskop. Diesmal ist eins jedoch wie oben unter polarisiertem Licht betrachtet worden und das andere ohne polarisiertes Licht. Anhand der Aufnahmen kann man den Unterschied und die Wirkung der jeweiligen Bilder sehr gut erkennen und vergleichen. Durch die Kontrastverstärkung im polarisierten Licht erscheint der Kristall viel deutlicher. Seine komplette Struktur lässt sich mit Hilfe der ihn durchleuchtenden Lichtstrahlen, die dem Objekt ein buntes Farbenspiel verleihen, viel stärker hervorheben und erkennen. Nicht nur die Kontrastverstärkung, die durch das polarisierte Licht ermöglicht wird, sondern auch die sehr farbenreich erscheinende Abbildung, zeigt das Bild auf eine sehr unterhaltsame Art und Weise und verleit dem Mikroskopieren eine höchst interessante und spannende Enddeckungsreise in die Welt der Kristallbildung.

Kristall ohne polarisiertes Licht

Kristall unter polarisiertem Licht
Nachdem wir die Kristalle in ihrer normalen Erscheinungsform unter dem Mikroskop angeschaut haben, war es nun unsere Aufgabe die Kristalle auf dem Objektträger auskristallisieren zu lassen. Wir sind dabei so vorgegangen, dass wir bei ca. 50°C eine gesättigte Lösung von Acetylsalicylsäure in einer Ethanol/Wassermischung (1:1)
hergestellt haben. Um die Kristallisation am günstigsten zu bewirken, sollte die hergestellte Lösung um die 30-40°C betragen, da sonst bei höheren Temperaturen der Temperaturunterschied zwischen der Lösung und der Raumtemperatur zu groß wäre, um den Kristallwachstum auf der Videokamera festhalten zu können. Die Pipette die zum Tropfen der Lösung auf den Objektträger benötigt wird, wird ebenfalls gleich miterwärmt.
Es ist nicht nur günstig die Lösung auf bestimmter Temperatur zu halten, sondern auch den Objektträger kurz vor dem drauftropfen der Lösung warm zu machen, um ein wenig Zeit zu gewinnen bis der Objektträger auf dem Mikroskop seinen Platz eingenommen hat, bevor die Lösung anfängt auszukristallisieren.
Um die Kristalle bei ihrem Wachstum beobachten und aufnehmen zu können, sollten alle Einstellungen am Mikroskop vorher abgestimmt werden, sprich es sollte schon vorher die richtige Vergrößerung und die optimalste Belichtung eingestellt werden. Die Kammara wir in das Beobachtungsrohr eingesteckt und gleich nach dem Auftragen der Lösung auf den Objektträger eingeschaltet und die Kristalle beim wachsen aufgenommen.

Aufnahme eines Kristalls beim Auskristallisieren

Video: Kristallwachstum
 |
« zurück zur Übersicht - Projektarbeiten




