« zurück zur Übersicht - Projektarbeiten
 |
"Naturstoffe als Indikatoren"von Mara Heyer und Katrin Wittwer (Schuljahr 2005/06) |
| 1. Theoretische Grundlagen zum Thema Naturstoffe als Indikatoren | zum Seitenanfang  |
| 1-1. Indikation und Indikatoren - Definition | zum Seitenanfang  |
| 1-1.1 Indikation |
Der Begriff "indicare" stammt aus dem lateinischen und bedeutet "anzeigen".
Die Indikation ist also ein Vorgang, bei der das Erreichen oder Verlassen eines bestimmten Zustandes angezeigt wird.
| 1-1.2 Indikator |
Ein Indikator ist allgemein das Hilfsmittel, welches das Erreichen oder Verlassen eines Zustandes visualisiert.
Der Begriff findet nicht nur in der Chemie, sondern auch in anderen wissenschaftlichen Disziplinen wie Wirtschaft, Medizin, Mathematik, Biologie, Sozialwissenschaften und Technik Anwendung.
Speziell in der Chemie versteht man unter einem Indikator einen Stoff (oder ein Gerät), welcher dem Betrachter das Erreichen oder Verlassen eines bestimmten Zustands oder Vorgangs zum Beispiel optisch anzeigt, wobei das Verfolgen der Zustandsänderung ohne Indikator nicht möglich gewesen wäre.
| 1-1.3 Chemische Indikatoren |
In der Chemie dienen Indikatoren vorwiegend zur Endpunktsbestimmung einer Titration.
Bei der Titration handelt es sich um die Durchführung einer maßanalytischen Bestimmung.
Das Prinzip der Maßanalyse besteht im Zugeben eines bekannten Volumens einer Reagenzlösung bekannten Gehaltes zu einer Analysenlösung, wobei sich der zu bestimmende Stoff (Analyt) schnell, genau, definiert und quantitativ mit dem Reagenz über eine chemische Reaktion umsetzt.
Aus dem verbrauchten Volumen an Reagenzlösung und dem Gehalt des in ihr enthaltenen Reagenzes lässt sich schließlich die Menge des Analyten berechnen.
Da der Zeitpunkt der vollständigen Umsetzung in den meisten Fällen nicht ohne Hilfsmittel erkennbar ist, bedient man sich der verschiedenen Indikationsmöglichkeiten.
Dabei unterscheidet man zwischen physikalisch-chemischen Indikationsmöglichkeiten (instrumentelle Verfahren), die sich eine physikalische oder elektrochemische Veränderung zu Nutze machen, und chemischen Indikatoren, Stoffen, die auf Grund einer chemischen Reaktion eine Farbreaktion zeigen.
Chemische Indikatoren zeigen den Endpunkt einer Titration optisch durch eine Farbreaktion an.
Gemäß den verschiedenen Arten von chemischen Reaktionen und chemischen Vorgängen unterscheidet man zwischen
- pH-Indikatoren (= Säure-Base-Indikator)
- Redoxindikatoren
- Metallindikatoren (= komplexometrische Indikatoren)
sowie den selteneren
- Adsorptionsindikatoren
- Chemilumineszenzindikatoren
- Fluoreszenzindikatoren
1-1.1.1 pH-Indikatoren
Zusätzlich zum Einsatzgebiet der Endpunktsindikation einer Neutralisationstitration, werden pH-Indikatoren unter anderem zur Bestimmung von pH-Werten, oder aber auch für kinetische Untersuchungen verwendet.
Dabei handelt es sich bei einem pH-Indikator um einen organischen Farbstoff und selbst um eine schwache Säure oder Base.
Solch ein Indikator-Farbstoff zeigt bei seiner Protolyse oder Deprotolyse einen Farbwechsel. Die unterschiedliche Farbigkeit von protonierten und deprotonierten Farbstoff-Molekülen bezeichnet man als Halochromie.
Eingesetzt als Indikator bei einer Titration soll der Farbumschlag des pH-Indikators dort erfolgen, wo sich eine äquivalente Menge an Säure und Base miteinander umgesetzt haben (Äquivalenzpunkt: der Punkt bei einer Titration, an dem sich Reagenz und zu bestimmender Stoff äquivalent umgesetzt haben).
Die einzelnen Indikatoren unterscheiden sich in ihren Farben und in den pH-Bereichen, in denen sich ihre Farbe ändert.
Speziell unterscheidet man zwischen den sog.
- einfarbigen Indikatoren
- zweifarbigen Indikatoren
- Mischindikatoren und
- Universalindikatoren
Einfarbige Indikatoren (Bsp.: Phenolphthalein) schlagen entweder von einer Farbe nach farblos, oder von farblos in eine Farbe um.
Zweifarbige Indikatoren (Bsp.: Methylorange) schlagen von einer Farbe über eine Mischfarbe in eine andere Farbe um.
Bei einem Mischindikator (Bsp.: Bromkresolgrün/Methylrot) handelt es sich entweder um eine Mischung aus zwei Indikatoren mit ungefähr gleichem Umschlagsbereich, oder um eine Mischung aus einem pH-Indikator und einem pH-unabhängigen Farbstoff.
Beide Arten von Mischungen haben den Zweck eine besser erkennbare Farbänderung zu erzeugen.
Ein Universalindikator ist eine Mischung aus mehreren pH-Indikatoren mit verschiedenen Umschlagsbereichen, so dass sich die Farbe über einen größeren pH-Bereich kontinuierlich ändert (Einsatz zur einfachen und schnellen Bestimmung des pH-Werts einer Lösung).
1-1.1.2 Redoxindikatoren
Bei Redoxindikatoren (Bsp.: Ferroin) handelt es sich um reduzier- oder oxidierbare Stoffe, wobei sich reduzierte und oxidierte Form des Stoffes in ihrer Farbe unterscheiden.
Sie werden eingesetzt, um Redoxreaktionen zu verfolgen, um Redoxpotentiale in etwa zu bestimmen, sowie um den Endpunkt einer Redoxtitration zu indizieren, einer Titration, bei der reduzier- oder oxidierbare Stoffe bestimmt werden. Die Farbänderung erfolgt hier nicht bei einem bestimmten pH-Wert, sondern bei einem bestimmten Redoxpotential, welches in der Nähe des Redoxpotentials des Äquivalenzpunktes liegen sollte.
1-1.1.3 Metallindikatoren
Bei den Metallindikatoren (Bsp.: Eriochromschwarz T) handelt es sich um organische Stoffe, die mit Metallionen Komplexe bilden können. Der freie Indikator hat dabei eine andere Farbe, als die komplexierte Form.
Sie werden zur Endpunktsbestimmung einer komplexometrischen Titration eingesetzt, einer Titration, bei der Metallkonzentrationen ermittelt werden und Chelatbildner als Maßlösung dienen.
Metallindikatoren finden aber auch Anwendung bei der katalytischen Bestimmung der Konzentration von Metallionen.
1-1.1.4 Adsorptions- und Fluoreszenzindikatoren
Adsorptions- und Fluoreszenzindikatoren werden bei sog. Fällungstitrationen zur Endpunktsbestimmung verwendet, Titrationen, bei denen der Analyt bei Zugabe des Reagenzes in Form eines schwer löslichen Niederschlags ausgefällt wird.
| 1-2. Von den natürlichen zu den chemischen Indikatoren | zum Seitenanfang  |
Ein geschichtlicher Überblick
Bereits im 16. Jahrhundert entdeckte Leonhard Thurneysser zum Thurn wie sich Schweflige Säure und Schwefelsäure voneinander unterscheiden lassen: Schweflige Säure entfärbte Veilchensaft, wohingegen Schwefelsäure diesen rot werden ließ.
Im Jahre 1750 verwendete auch Gabriel Francois Venel den Farbindikator Veilchensaft bei einer Mineralwasseranalyse und beobachtete die Rotfärbung beim Zusatz von Schwefelsäure.
1663 beschrieb Robert Boyle in seinem Buch "Experimenta et considerationes de coloribus“ das Verhalten von Pflanzensäften, wie zum Beispiel Veilchen, Kornblume und Lackmus gegenüber Säuren und Basen.
So standen den Analytikern zu den Entstehungszeiten der Maßanalyse nur Pflanzenfarbstoffe zur Verfügung.
1776 verwendete William Lewis in Lackmuslösung getränktes Löschpapier, um die absoluten Gehalte von Pottasche zu bestimmen.
1782 dienten Louis Bernard Guyton de Morveau in Curcuma und Fernambuktinktur getränkte Filterpapierstreifen zur Bestimmung von Salzsäure und Salpetersäure, und George Fordyce benutzte 1792 Veilchensaft zur Titration von Säuren.
Zu Beginn des 19. Jahrhundert führte Francois Antoine Henri Descroizilles die erste Redoxtitration durch, und verwendete dabei sich entfärbende schwefelsaure Indigolösung als Reagenzlösung.
1822 schrieb Christian Heinrich Pfaff in seinem "Handbuch der analytischen Chemie“ von 11 Indikatoren, wie zum Beispiel Lackmus, Fernambuk, Curcuma und Kohl.
Mitte des 19. Jahrhunderts verwendete Joseph Louis Gay-Lussac Lackmustinktur als Indikator zur Einstellung von Schwefelsäure-Maßlösung.
1835 benutzte er als erster Indigo-Lösung als Redoxindikator zur Erkennung des Endpunktes der Titration des Hypochlorits mit arseniger Säure.
1840 diente Alphonse Du Pasquier Stärke als Indikator zur Titration von Hydrogensulfid mit alkoholischer Iodmaßlösung und Walter Crum verwendete das Kaliumhexacyanoferrat(III) als Tüpfelindikator bei der Hypochloritbestimmung mit Eisen(II)sulfatlösung.
1850 bzw. 1851 verwendeten Frederick Penny und Jacob Schabus Kaliumhexacyanoferrat(II) als Tüpfelreagenz zur Anzeige des Endpunktes einer Eisentitration mit Kaliumdichromatlösung.
1852 benutzte Penot Iod-Stärke-Lösung als Tüpfelreagenz zur Hypochloritbestimmung mit arseniger Säure.
Im Laufe des 19. Jahrhunderts titrierte Jacob Volhard Chlorid, Silber, sowie Quecksilber mit Ammoniumeisen(III)sulfat als Indikator.
Gegen Ende des 19. Jahrhunderts schließlich kamen die ersten synthetischen Farbstoffe auf den Markt, die sich als geeignete Säure-Base-Indikatoren erwiesen, da sich ihr Farbumschlag gegenüber denen der natürlichen Farbstoffe schärfer erkennen ließ, so zum Beispiel 1877 Phenolphthalein (durch E. Luck), 1878 Tropäolin 00 und Methylorange (durch M. Müller und Georg Lunge), sowie 1908 Methylrot (durch E. Rupp und R. Loose).
1915 führten William Mansfield Clark und Herbert August Lubs die Sulfophthaleine ein.
1915 schließlich entdeckte Josef Knop das Diphenylamin als den ersten richtig zu gebrauchenden Redoxindikator.
1876 schlug F. Krüger Fluorescin als Fluoreszenzindikator für Säure-Base-Titrationen vor.
1923 schließlich verwendeten Kasimir Fajans und Odd Hassel Fluorescin als Adsorptionsindikator zur argentometrischen Bestimmung von Chlorid.
Ab 1945 dienten Gerold Schwarzenbach Aminopolycarbonsäuren für Komplexbildungstitrationen.
Mit der zunehmenden Weiterentwicklung der Redoxtitration und der Komplexometrie kamen im Laufe der Zeit noch zahlreiche Farbindikatoren hinzu.
Seit Beginn der Erforschung der instrumentellen Methoden der Endpunktsbestimmung und der ersten potentiometrischen Titration 1893 durch Robert Behrend waren Farbindikatoren jedoch nicht mehr die einzige Wahl in Bezug auf die Frage zur Endpunktsbestimmung einer Titration.
| 1-3. Einsatz von Säure-Base-Indikatoren bei der Neutralisationstitration | zum Seitenanfang  |
Die Neutralisationstitration lässt sich unterteilen in die sog. Alkalimetrie und die sog. Acidimetrie.
Bei der Alkalimetrie wird eine Säure mit einer starken Base titriert (wie zum Beispiel CH3COOH mit NaOH), bei der Acidimetrie eine Base mit einer starken Säure (wie zum Beispiel NaOH mit HCl).
Die der Neutralisationstitration zu Grunde liegende Reaktion entspricht also dem Protonenübergang von einem Reaktionspartner auf den anderen.
Eine Titrationskurve stellt den Titrationsverlauf graphisch dar, wobei im vorliegenden Fall der Neutralisationstitration der pH-Wert über dem sog. Titrationsgrad oder dem Volumen an zugegebener Maßlösung abgetragen wird.
Beim Titrationsgrad handelt es sich um das Verhältnis der Äquivalenzstoffmenge des zugegebenen Reagenzes zur Ausgangsäquivalentstoffmenge des zu bestimmenden Stoffes.
| 1-3.1 Titration einer starken Säure mit einer starken Base |
Für die Titration einer starken Säure mit einer starken Base sieht die zugehörige Titrationskurve folgendermaßen aus:
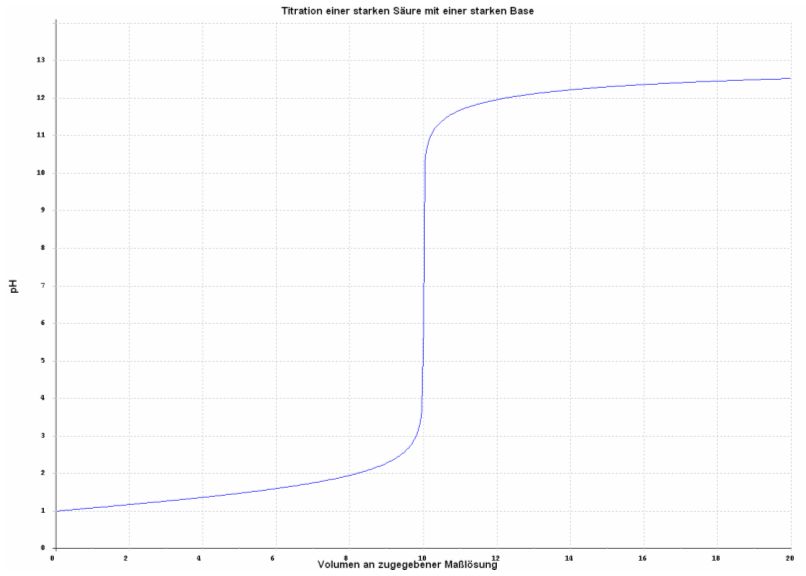
Abb. 1
Kurve erstellt mit Hilfe des Programms: Laborant Chemstation für Windows 1.21
Vorlage: 10 ml 0,1 M Salzsäure
Maßlösung: 0,1 M Natronlauge
Zugehörige Reaktionsgleichung: HCl + NaOH → NaCl + H2O
Mit zunehmendem Volumen an Maßlösung steigt der pH-Wert zunächst langsam, dann schneller und schließlich sprunghaft an, bis er nur noch langsam bis sehr langsam steigt.
Inmitten des pH-Sprungs, der durch Zusatz von minimalem Volumen an Maßlösung ausgelöst wird, weist die Kurve einen Wendepunkt auf, den sog. Äquivalenzpunkt. Am Äquivalenzpunkt steigt der pH-Wert am stärksten an und Säure und Base sind eins zu eins (äquivalent) umgesetzt.
Im Falle der Titration einer starken Säure mit einer starken Base fällt der Äquivalenzpunkt mit dem Neutralpunkt zusammen.
Je verdünnter die vorgelegte Säure ist, desto kleiner ist der pH-Sprung am Äquivalenzpunkt, wie die folgende Titrationskurve belegt.
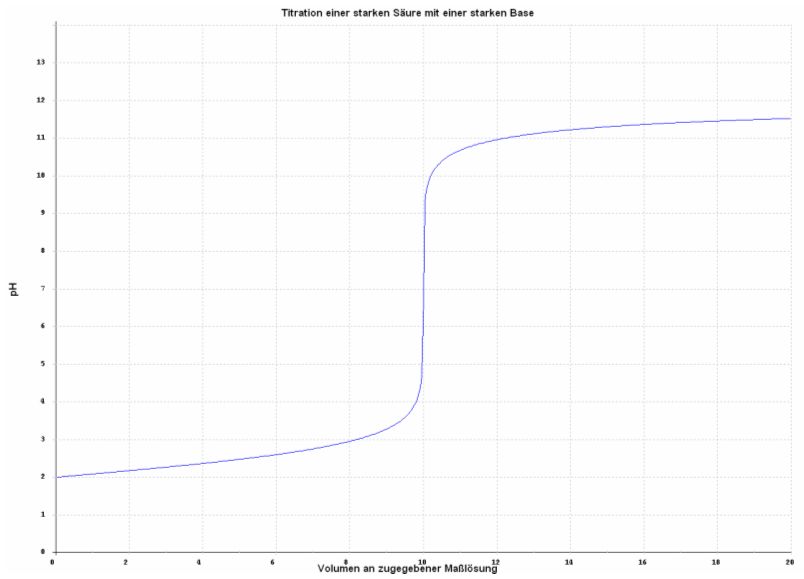
Abb. 2
Kurve erstellt mit Hilfe des Programms: Laborant Chemstation für Windows 1.21
Vorlage: 10 ml 0,01 M Salzsäure
Maßlösung: 0,01 M Natronlauge
Zugehörige Reaktionsgleichung: HCl + NaOH → NaCl + H2O
Für die Titration einer starken Base mit einer starken Säure verläuft die entsprechende Titrationskurve gerade andersherum.
Der Äquivalenzpunkt (theoretischer Endpunkt einer Titration), welcher meist nicht mit bloßem Auge erkennbar ist (die bei der Titration gebildeten Salze sind zum größten Teil farblos), wird unter Zuhilfenahme eines pH-Indikators sichtbar gemacht.
Hierfür ist ein Indikator zu suchen, dessen Farbumschlag möglichst nah am pH-Wert des Äquivalenzpunktes liegt, und dessen Umschlagsbereich sich im steilen Teil der Kurve befindet.
Es eignen sich besonders solche Indikator-Substanzen, die in einen relativ engen pH-Bereich, sowie einen scharfen und visuell gut erkennbaren Farbumschlag zeigen.
Speziell: Der Farbumschlag eines pH-Indikators:
Da es sich bei einem pH-Indikator selbst um eine schwache Säure, bzw. Base handelt, lässt sich beispielhaft für eine Indikatorsäure folgende allgemeine Indikatorgleichung aufstellen:
![]()
Wendet man auf dieses Protolysegleichgewicht das Massenwirkungsgesetz an und logarithmiert beide Seiten der Gleichung, dann erhält man die sog. Puffergleichung oder Henderson-Hasselbalch-Gleichung:
![]()
Mit Hilfe dieser Gleichung lässt sich der Zusammenhang zwischen Stärke der Indikatorsäure und Lage des Umschlagsbereiches des Indikators quantifizieren:
Im Umschlagsbereich des Indikators sind die Konzentrationen an Indikatorsäure und an Indikatorbase ungefähr gleich groß und es liegt eine Mischfarbe vor.
Setzt man nun c(HInd) = C(Ind-) in die Henderson-Hasselbalch-Gleichung ein, dann ergibt sich dafür
![]()
Eine Mischfarbe liegt auch vor, wenn die eine oder andere Konzentration etwas überwiegt.
Das menschliche Auge erkennt jedoch erst dann die reine Farbe aus der Farbmischung, wenn das Verhältnis der Konzentrationen von Indikatorsäure und Indikatorbase 1:10, bzw. 10:1 beträgt.
Eingesetzt in die Henderson-Hasselbalch-Gleichung ergibt dies einen pH-Bereich von
![]()
in welchem der Umschlag des Indikators von der einen reinen Farbe zur anderen erfolgt.
Ein Indikator besitzt also keinen Umschlagspunkt, sondern einen Umschlagsbereich, wobei der eines pH-Indikators in der Regel 2 pH-Einheiten um den pKs der Indikatorsäure herum liegt.
Indikatoren mit hohen pKs-Werten wechseln ihre Farbe also bei kleinen pH-Werten.
Für die Titration einer starken Säure mit einer starken Base sind alle pH-Indikatoren brauchbar, welche nahe bei pH = 7 umschlagen.
Da der Fehler einer Titration meist nicht über 0,1% liegen soll, können jene Indikatoren verwendet werden, die in dem pH-Bereich liegen, der von 0,1% mehr oder weniger an Maßlösungszusatz überstrichen wird.
Dies entspricht bei der Titration einer starken Säure mit einer starken Base bei einem Konzentrationsbereich von 0,1 mol/l einem Grenzbereich von pH = 4 bis pH = 10, bei einem Konzentrationsbereich von 0,01 mol/l einem Grenzbereich von pH = 5 bis pH = 9.
| 1-3.2 Titration einer schwachen Säure mit einer starken Base |
Für die Titration einer schwachen Säure mit einer starken Base sieht die zugehörige Titrationskurve folgendermaßen aus:
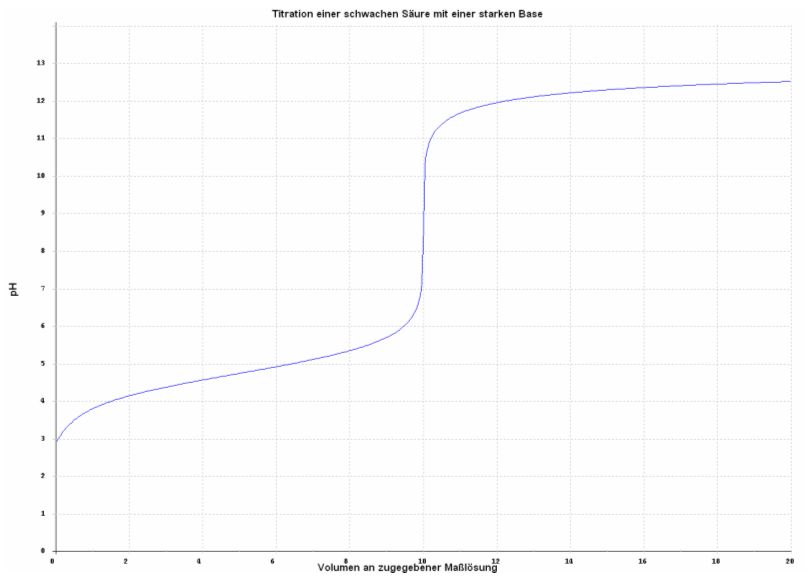
Abb. 3
Kurve erstellt mit Hilfe des Programms: Laborant Chemstation für Windows 1.21
Vorlage: 10 ml 0,1 M Essigsäure
Maßlösung: 0,1 M Natronlauge
Zugehörige Reaktionsgleichung: CH3COOH + NaOH → CH3COONa + H2O
Vor der Zugabe der Base bestimmt die schwache Säure den pH-Wert der Lösung.
Nach Zugabe der Base und vor dem Äquivalenzpunkt liegt ein Puffergemisch aus schwacher Säure und ihrem zugehörigen Salz vor.
Nach dem Äquivalenzpunkt bestimmen die überschüssigen Hydroxydionen den pH-Wert.
Am Äquivalenzpunkt liegt das Salz der titrierten Säure vor, und dieses bestimmt den pH-Wert.
Äquivalenzpunkt und Neutralpunkt fallen also im Fall der Titration einer schwachen Base mit einer starken Säure nicht mehr zusammen, sondern der Äquivalenzpunkt verschiebt sich in den alkalischen Bereich.
Für die Titration einer schwachen Base mit einer starken Säure erfolgt eine Verschiebung des Äquivalenzpunktes in den sauren Bereich.
Für die Titration von Essigsäure (=schwache Säure) mit Natronlauge liegt der Äquivalenzpunkt bei einem pH-Wert von 8,8, der vom Salz der Essigsäure (Acetat) herrührt.
Der zugelassene Indikatorumschlagsbereich für diese Titration liegt zwischen pH = 7,75 und pH = 10.
| 1-3.3 Titration einer schwachen Säure mit einer schwachen Base |
Bei der Titration von schwachen Säuren mit schwachen Basen oder umgekehrt liegt eine nur geringe und zusätzlich auch noch schleppende Änderung der H3O+-Ionen-Konzentration vor, so dass nur ein niedriger und zusätzlich auch noch flacher pH-Sprung erfolgt.
Für die Endpunktsindikation können deswegen keine Farbindikatoren eingesetzt werden, in diesem Fall muss man sich instrumenteller Indikationsmethoden, wie z.B. der Konduktometrie oder Potentiometrie bedienen.
Auch in dem Fall, dass die zu titrierende Lösung eine intensive Eigenfärbung besitzt, muss auf Farbindikatoren verzichtet werden, und auf instrumentelle Indikationsmethoden zurückgegriffen werden.
Zusammenfassung:
Für Neutralisationstitrationen gilt:
je stärker die zu titrierende Säure (Base), desto steiler der pH-Sprung beim Äquivalenzpunkt
je höher die Ausgangskonzentration der zu titrierenden Säure (Base), desto höher gestaltet sich der pH-Sprung
je schwächer die zu titrierende Säure (Base), desto weiter verschiebt sich der Äquivalenzpunkt vom Neutralpunkt weg ins Alkalische (Saure)
| 1-3.4 Indikatorfehler |
Der Äquivalenzpunkt einer Titration und der mit Hilfe des verwendeten Indikator ermittelte Endpunkt fallen in der Regel nicht exakt zusammen.
Die Differenz zwischen ermitteltem und theoretischem Endpunkt bezeichnet man als Indikatorfehler.
Der Indikatorfehler hängt ab
- vom jeweilig ausgewählten Indikator
- von der Temperaturabhängigkeit des Indikatorumschlags
- von der Verdünnung der zu titrierenden Lösung
- vom Neutralsalzgehalt
- von der Indikatorkonzentration etc.
| 1-3.5 Besonderheit eines pH-Indikators: Der isosbestische Punkt |
Die Absorptionsspektren eines pH-Indikators bei verschiedenen pH-Werten schneiden sich in einem Punkt, dem sog. isosbestischen Punkt.
Bei der Wellenlänge dieses Punktes liegt unabhängig vom pH-Wert der gleiche molare Extinktionskoeffizient des Indikatorfarbstoffes vor und pH-Wert-unabhängige Konzentrationsmessungen des Farbstoffes werden möglich.
| 1-4. Naturstoffe - Definition | zum Seitenanfang  |
Als Naturstoffe bezeichnet man im Allgemeinen Substanzen, die aus Tieren, Pflanzen und Mikroorganismen gewonnen werden. Früher zählte man auch Stoffe mineralischer Herkunft zu den Naturstoffen, heute bezieht man sich lediglich auf organische Substanzen natürlichen Ursprungs. Naturstoffe zeichnen sich durch sehr große strukturelle Vielfalt aus und besitzen ebenso vielfältige Wirkungen.
| 1-5. Farbstoffe | zum Seitenanfang  |
| 1-5.1 Definition |
Als Farbstoffe werden in Lösungsmitteln und / oder Bindemitteln lösliche Farbmittel bezeichnet. Sie werden in organische und anorganische Farbmittel und diese wieder in natürliche und synthetische Farbmittel unterteilt. Alle anorganischen Farbmittel sind Pigmente, während organische Farbmittel sowohl Pigmente als auch Farbstoffe umfassen.
Farbstoffe zeigen eine große Anzahl und Strukturvielfalt im Vergleich zu den Pigmenten auf. Ebenso sind sie den Pigmenten in der Leuchtkraft meist überlegen.
Es existieren viele Zehntausende verschiedene Farbstoffe von denen etwa 6.000 - 7.000, in bedeutenderen Mengen nur etwa 500 technische Verwendung finden. Dagegen kennt man nur etwa 100 reine Pigmente.
Farbstoffe werden vor allem zum Färben von technischen Artikeln, Textilien, Lebensmitteln, in der Kosmetik, in Druckfarben, Anstrichstoffen, Lacken, etc. verwendet.
| 1-5.2 Zustandekommen von Farben |
Eine Substanz weißt eine Farbe auf, wenn sie elektromagnetische Wellen bestimmter Länge absorbiert. Erfolgt diese Absorption im Bereich des sichtbaren Lichts, so erscheint uns die Substanz farbig. Sichtbar ist jedoch immer die Komplementärfarbe zur Farbe des absorbierten Lichts (vergleiche Tabelle). Nur in seltenen Fällen entsteht der Farbeindruck direkt aus der Emission der absorbierten Energie.
Voraussetzung für die Farbigkeit eines Stoffes ist, dass Elektronen vorhanden sind, die bereits durch energiearmes sichtbares Licht angeregt werden können. Je mehr die Elektronen lokalisiert sind umso leichter lassen sie sich anregen.
Um die Farbigkeit von Farbstoffen zu erklären bedarf es bei bestimmten Typen die Fähigkeit der Halochromie und die Neigung Chelat-Metallkomplexe und Farblacke zu bilden.
Zusammenhang zwischen Wellenlänge der absorbierten Strahlung und Farbe bzw. Farbeindruck

| 1-6. Einteilung in natürliche und synthetische Farbstoffe | zum Seitenanfang  |
Farbstoffe lassen sich unterteilen in natürliche und künstliche Farbstoffe.
Natürliche Farbstoffe kommen in Tieren und Pflanzen vor und sind deshalb auch fast ausschließlich organische Substanzen. Mineralische Farben wie z.B. Mennige zählen zu den Pigmenten, die wasserunlöslich sind.
Synthetische Farbstoffe werden weiter unterteilt in:
- Azofarbstoffe
- Polymethinfarbstoffe
- Triphenylmethanfarbstoffe
- Carbonlyfarbstoffe
Zu den Azofarbstoffen gehören Indikatoren wie Methlyrot oder Methylorange. Sie sind die größte Gruppe der künstlichen Farbstoffe. Ausgangsstoffe zur Synthese sind Benzol oder Naphthalin. Allgemein werden Azofarbstoffe zum Färben verwendet. Zu ihnen gehören auch künstliche Lebensmittelfarbstoffe.
Zu den Polymethinfarbstoffen zählt z.B. das Chinolinblau, ein Farbstoff der in der Mikroskopie oder der Fotografie gebraucht wird.
Triphenylmethanfarbstoffe sind Farbstoffe wie Fuchsin oder Malachitgrün. Anwendung finden sie hauptsächlich in der Drucktechnik oder als Indikatoren, wegen ihrer geringen Wasch- und Lichtechtheit jedoch weniger als Textilfärbemittel.
Carbonylfarbstoffe sind z. B. Indigo- oder Anthrachinonfarbstoffe. Diese Farbstoffe werden synthetisch hergestellt kommen aber auch in der Natur vor.
Natürliche Farbstoffe unterteilt man in:
- Carotinoide
- Flavonoide
- Chinonfarbstoffe
- Anthocyane
- Pyrrolfarbstoffe
- Betanin
- Curcumin
- Orzein
Carotinoide sind lipophil und zeigen meist gelbe, rote und manchmal auch rotviolette Farbtöne. Sie sind in Flora und Fauna weit verbreitet. Bis heute sind von ihnen über 400 verschiedene Carotinoide bekannt.
Die größte Gruppe an natürlichen Farbstoffen bilden die Flavonoide mit über 600 verschiedenen Stoffen. Flavonoide sind alle gelbfärbend. Sie sind wasserlöslich und kommen in Blüten, Blättern und Früchten vor und sind auch als spezielle Farbstoffe in Tees enthalten.
Chinone bilden die drittgrößte Gruppe an natürlichen Farbstoffen. Zu ihnen zählen heute über 200 verschiedene Einzelstoffe. Ihre Farbpalette reicht von Gelb bis Schwarz. Sie sind wasserlöslich und hitzebeständig. Chinone findet man in Blütenpflanzen, Pilzen, Moosen, Algen oder Bakterien.
Anthocyane besitzen hellrote bis blauviolette Färbungen. Sie kommen in Blüten und Früchten in gelöster Form vor.
Charakteristisch für diese Farbstoffgruppe ist, dass sie als Indikatoren verwendet werden können.
Zu den Pyrrolfarbstoffen zählen die Chlorophylle, Hämfarbstoffe und auch Gallenfarbstoffe. Sie sind sowohl wasser- als auch fettlöslich, was aber von ihrem chemischen Aufbau abhängig ist.
Betanin, Curcumin und Orzelin lassen sich nicht zu einer der hier genannten Gruppen zuordnen. Betanin gewinnt man aus der Roten Beete oder aus Roten Rüben, Curcumin ist der Hauptbestandteil des Gelben Ingwer, der Gelbwurzel und Orzein ist in vielen Flechten enthalten.
Heute sind die Naturfarbstoffe vollständig von den synthetischen Farbstoffen verdrängt worden.
| 1-7. Natürliche Indikatoren | zum Seitenanfang  |
| 1-7.1 Einsatz in der Chemie |
Manche Naturstoffe eignen sich als Indikatoren und fanden früher in der Chemie Verwendung. Es sind die enthaltenen Farbstoffe, welche die Indikatoreigenschaften ausmachen. Jedoch sind nicht alle natürlichen Farbstoffe gleichzeitig Indikatoren.
Folgende natürliche Farbstoffe eignen sich als Indikatoren:
- Anthocyane
- Alizarin
- Indigocarmin
- Lackmus
- Curcumin
1-7.1.1 Anthocyane
Anthocyane kommen in sehr vielen Pflanzen vor. Pflanzen, die Anthocyane enthalten, haben die Eigenschaft eines Säure/Base-Indikators. Die Ausprägung der Eigenschaft ist abhängig von den Anthocyanidinen, die in einer Pflanze vorhanden sind.
Schon Goethe experimentierte mit Lebensmitteln und verschiedenen Blüten, die Anthocyane enthalten und dokumentierte die unterschiedlichen Farbänderungen bei der Zugabe von Säure oder Lauge. Er war aber noch nicht in der Lage genaue Begründungen für diesen Farbwandel zu liefern.
Anthocyane sind enthalten in:
| Blüten: | Malven, Veilchen, violetten und blauvioletten Stiefmütterchen, Kornblumen, Mohn, roten Rosen, orangenen Dahlien, bläulichen Kartoffelblüten, Lavendel, gelb-rote Tulpen, Pfingstrosen, Petunien |
| Blätter: | roten Rosskastanienblättern |
| Früchten: | Hagebutten, Holunderbeeren, Ligusterbeeren |
| Obst: | Blaubeeren, roten Johannisbeeren, Kirschen, Erdbeeren, Trauben, Pflaumen, Preiselbeeren, Zwetschgen, Blutorangen |
| Gemüse: | Rotkohl, Radieschen, Auberginen |
| und viele weitere. | |
Anthocyane kommen also in vielen rötlichen Pflanzen vor. Sie liegen in Zellsäften der Blüten, Früchte und Blätter in gelöster Form vor.
Die Farbpalette der Anthocyane reicht von hellrot bis blauviolett. Die einzelnen Anthocyanidine sind sehr pH-empfindlich. Bei pH-Werten über 3,8 nimmt ihre Farbintensität stark ab und ihre Farbe verändert sich gegen grau bis bläulich.
1-7.1.2 Indigocarmin
Indigocarmin ist ein Redox-Indikator organischen Ursprungs. Das aus der Indigopflanze gewonnene Indigo wird dafür chemisch zum Indigocarmin umgewandelt.
Indigocarmin ist ein blaues, wasserlösliches Pulver. Es ist sehr empfindlich gegenüber Licht und Oxidationsmittel. Früher wurde Indigocarmin als Färbemittel zum Bläuen der Wäsche verwendet, wurde jedoch von den optischen Aufhellern in Waschmitteln verdrängt.
Sein Umschlagsbereich liegt zwischen pH 11,5 und 13 mit dem Farbumschlag von blau nach gelb. Indigocarmin kann man zum Nachweis von Nitraten, Chloraten und zur Milchprüfung verwenden.
1-7.1.3 Alizarin
Alizarin kommt natürlicherweise glycosidisch gebunden in der Wurzel der Krapppflanze vor. Es ist eine orangegelbe kristalline Substanz, die in Wasser sehr schlecht, aber umso mehr in Ether, Alkoholen, aromatischen Kohlenwasserstoffen und Eisessig sehr gut löslich.
Mit verschiedenen Metalloxiden beziehungsweise Metallsalzen bildet Alizarin intensiv gefärbte Verbindungen.
Mit der viel seltener angewendeten Eisenbeize gibt Alizarin violette, mit Chrombeizen braunrote Farbtöne. Metallbeizen mit Alizarin-Färbungen sind resistent gegenüber Licht, Seifen, Säuren und schwachen Alkalien.
Heute wird Alizarin nur noch als Zwischenprodukt für die Herstellung von Alizarin-Farbstoffen verwendet. Ferner dient es als Indikator und zur Bestimmung von folgenden Metallen:
- Aluminium
- Gallium
- Indium
- Thorium
- Titan
- Chrom
- Hafnium
Die einzelnen Alizarin-Farbstoffe in Form von Indikatoren haben jeweils unterschiedliche Umschlagsintervalle und Farbumschläge.

1-7.1.4 Lackmus
Lackmus ist ein blauer Farbstoff, der aus verschieden tropischen Flechten wie zum Beispiel Variolaria, Roccella und Lecanora gewonnen wird (Farbstoffliefernde Flechten siehe Abbildung rechts).
Lackmus ist jedoch kein direkter Flechtenfarbstoff. Er wird erst durch künstliche und sehr aufwendige Gärung aus den Inhaltsstoffen der Flechten hergestellt. Der Farbstoff Lackmus setzt sich aus vielen verschiedenen roten, violetten und blauen Substanzen zusammen.
Lackmus ist mit dem Farbstoff Orcein verwandt, der aus Orcin herstellbar ist. Orcin wiederum ist wie Lackmus ein typischer Flechtenfarbstoff.
Früher wurde Lackmus zum Bläuen von Wäsche und als Lebensmittelfarbstoff genutzt. Zum Färben von Textilien ist es leider wegen seiner Farbumschläge in Säuren und Laugen ungeeignet.
Heute verwendet man Lackmus ausschließlich als Säure-Base-Indikator. Sein Umschlagsbereich liegt zwischen den pH-Werten 5 und 8. Der Farbumschlag verläuft von rot im Sauren nach blau im Alkalischen.
1-7.1.5 Curcumin
Curcumin wird aus der Gelbwurzel gewonnen und stammt aus Südostasien. Es ist ein Gemisch aus drei sehr ähnlichen gelben Farbstoffen. Sein Umschlagsbereich liegt bei pH-Wert 7,4 bis 8,6 mit dem Farbumschlag von hellgelb im Sauren nach rotbraun im Alkalischen. Mehr dazu aber später.
1-7.1.6 Weitere natürliche Indikatoren
Viele Teesorten eignen sich ebenfalls als Indikatoren für Säuren und Basen. Sehr bekannt ist der Versuch mit Schwarztee am Frühstückstisch. Versetzt man den Tee mit etwas Zitronensaft, so hellt sich seine Farbe auf.
| 1-7.2 Natürliche Indikatoren auf einem anderen Gebiet |
Bioindikatoren
Als Bioindikatoren bezeichnet man Organismen, einer oder mehreren Arten die aufgrund von Umweltbelastungen ihren physikalischen, chemischen oder biologischen Status ändern, oder Individuen dieser Arten die Wechselwirkungen durch Umweltbelastung erfahren. Bioindikatoren werden dazu verwendet natürlich vorkommende oder neu hinzukommende Organismen eines Ökosystems zu untersuchen.
Die meistverwendete Möglichkeit der Bioindikation sind Indikatorpflanzen.
Diese zeigen eine relativ geringe Reaktionsbreite gegenüber Umweltfaktoren. Die Umweltfaktoren können wichtig, aber auch umweltschädlich sein. Aussagen über die Wirkung werden meist über die Toleranz und die Anwesenheit der Indikatorpflanzen gemacht.
Beispiele für Bioindikatoren sind Flechten oder Veilchen. Nehmen Veilchen Schwefeldioxid auf, so werden die vorhandenen Farbstoffe abgebaut.
Rotkohl ist ebenfalls eine Art Bioindikator. Ist der Boden auf dem der Kohl wächst neutral, so nimmt der kohl eine bläuliche Farbe an. Liegt der pH-Wert des Bodens im Sauren Bereich, so ist der Kohl rötlicher.
| 1-8. Naturstoffe als Indikatoren - zwei Beispiele genauer betrachtet | zum Seitenanfang  |
| 1-8.1 Rotkohl |
Der Rotkohl, wissenschaftlich auch brassica oleracea var. capitata f. rubra genannt, gehört zur Familie der Kreuzblütengewächse, und zur Gattung Kohl.
Es handelt sich dabei um ein typisches Wintergemüse, wobei die Pflanze in rohem Zustand eine violette Farbe aufweist.
Der Rotkohl trägt je nach Gegend viele unterschiedliche Namen:
Ob Rotkohl, Rotkraut, Blaukohl, oder Blaukraut, jede dieser Bezeichnungen meint ein und dasselbe Gemüse. Die unterschiedlichen Namen entwickelten sich auf Grund einer besonderen Eigenschaft des Rotkohls: der im Kohl enthaltene Farbstoff ändert je nach vorliegendem pH-Wert seine Farbe.
So erscheint der Kohl in sauren Böden rot, in alkalischen Böden jedoch bläulich.
Ebenso erhielt das aus dem Kohl zubereitete Kraut durch die unterschiedlichen Zubereitungsvorlieben in den verschiedenen Gegenden Deutschlands auch unterschiedliche Namen:
In Norddeutschland oder im Badischen zum Beispiel verwendet man vorwiegend saure Zutaten wie Essig und Wein, wodurch das Kraut eine rötliche Farbe erhält (Rotkraut). Bei den Schwaben und in Bayern jedoch verwendet man Zucker oder sogar alkalische Zutaten, welche das Kraut violett bis bläulich färben (Blaukraut).
Die Farbreaktionen des Rotkohls sind auf die im Zellsaft des Kohls gelösten pH-abhängigen Farbstoffe, die Anthocyane, zurückzuführen (siehe auch Kapitel natürliche Farbstoffe).
Im sauren Milieu färbt sich Rotkohlsaft rot, mit zunehmendem pH-Wert ändert sich seine Farbe über violett nach blau (im Neutralen), im alkalischen Milieu geht die Farbe über grün zu gelb über.
Rotkohlsaft zeigt also über den ganzen pH-Bereich hinweg verschiedene Farben, er ist also ein regelrechter Universalindikator!
Die Anthocyane bilden eine Gruppe von pH-empfindlichen violetten und roten Farbstoffen, den sog. Benzopyrylium-Salzen.
Chemisch gesehen sind Anthocyane Glykoside, wobei ihre Aglykone, die sog. Anthocyanidine, die eigentlichen Chromophoren (Farbstoffkomponenten) darstellen. Im Zellsaft sind diese Anthocyanidine in 3- oder 5-Stellung über einen Hydroxylrest mit einem Zucker, maximal zwei Monosacchariden oder einem Disaccharid, verbunden.
Anthocyanidin und Zucker lassen sich enzymatisch oder durch Zusatz von verdünnten Säuren voneinander trennen.
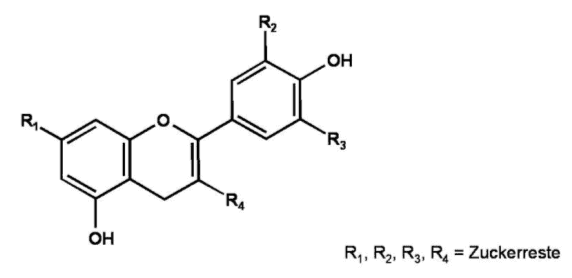
Abb. 5
Erstellt mit Hilfe des Programms C-Design_3
Grundstruktur der Anthocyane
Das Grundgerüst der Anthocyanidine bildet ein Pyranring mit ankondensiertem Benzolring. In Position zwei des Pyranrings befindet sich ein Phenylrest, der verschiedene Substituenten tragen kann. Bei den Anthocyanidinen handelt es sich also um Derivate des Flavylium-Kations. Die Glykosidform verleiht dem Farbstoff in den Pflanzen eine höhere Wasserlöslichkeit und eine höhere Stabilität, wobei im Sauren (pH<3) höchste Stabilität vorliegt.
Die Anthocyanidine leiten sich im Wesentlichen von 6 Grundstrukturen ab, die sich lediglich durch die Anzahl der Hydroxygruppen am Phenylring unterscheiden: dem Pelagonidin, Cyanidin, Delphinidin, Päonidin, Petunidin, und dem Malvidin.
Insgesamt wurden bis zu 300 verschiedene Anthocyane gefunden, wobei diese Vielfalt durch unterschiedliche Glykolisierungsgrade mit verschiedenen Hexosen und Pentosen, sowie durch zusätzliche Acylisierungen mit aliphatischen und aromatischen Säuren bedingt ist.
Aufgrund ihrer pH-Abhängigkeit wirken Anthocyane als Säure-Base-Indikatoren.
In den jeweiligen Pflanzen liegt im Allgemeinen eine Mischung aus mehreren verschiedenen Anthocyanen vor.
Im Rotkohl jedoch findet man hauptsächlich nur ein Anthocyan, das Glykosid des Cyanidins (Cyanidin-3-triglucosid), und in nur kleinen Konzentrationen die Cyanidinglykoside Raphanusin C und D, sowie Rubrobrassicin C.
Dieses vorwiegende Vorliegen von nur einem Anthocyanidin erklärt warum man beim Rotkohlsaft zwischen den einzelnen Farb-Stufen klare Farbumschläge erhält.
Zur Erklärung des Farbenspiels wird im Folgenden stellvertretend das Glykosid des Cyanidin verwendet.
Strukturen und Reaktionen des Cyanidin-3-triglucosids bei verschiedenen pH-Werten:
Bei pH-Werten < 3 liegt das sog. Flavyliumkation in Form eines Komplexes mit dem Säurerest vor. Der Farbeindruck ist rot.
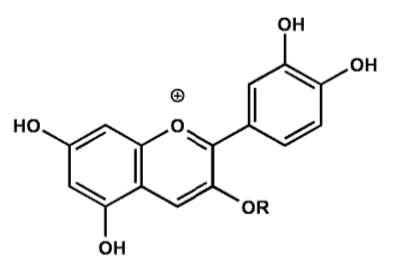
Abb. 6
Erstellt mit Hilfe des Programms C-Design_3
Flavyliumkation des Cyanidin-3-triglucosidBei pH-Werten 4-5 findet eine Hydroxylierung statt und es bildet sich eine Carbinol-Pseudo-Base (farblos).
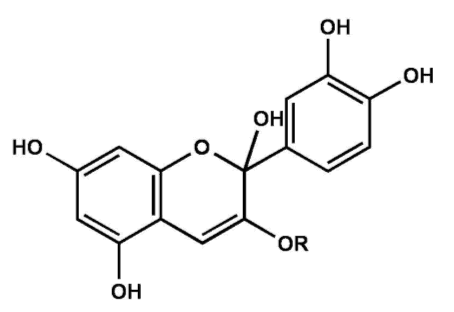
Abb. 7
Erstellt mit Hilfe des Programms C-Design_3
Carbinol-Pseudo-BaseBei einem pH-Wert von 6-7 erfolgt eine Dehydroxylierung, eine Hydroxylgruppe wandelt sich in eine Keto-Gruppe um, es liegt also ein chinoides System in Form der violetten Anhydrobase Flavenol vor.
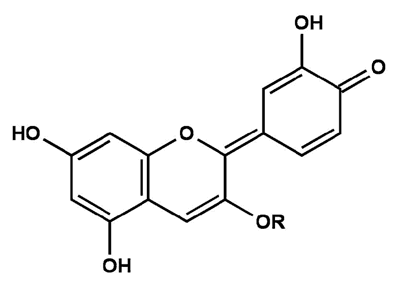
Abb. 8
Erstellt mit Hilfe des Programms C-Design_3
Chinoide Anhydrobase FlavenolBei einem pH-Wert von 7-8 entsteht durch Deprotonierung eine ionische Anhydrobase, das blaue Flavenolat-Anion.
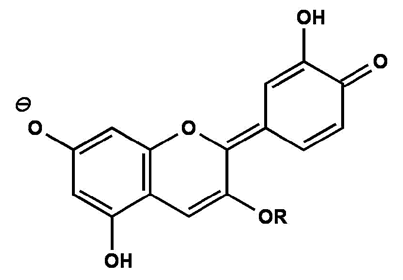
Abb. 9
Erstellt mit Hilfe des Programms C-Design_3
Ionische Anhydrobase Flavenolat-AnionIm Alkalischen Milieu liegen zwei deprotonierte Hydroxygruppen vor, wodurch am rechten Benzolring zwei doppelt gebundene Sauerstoff-Atome entstehen und dadurch in diesem Ring das mesomere System auseinander bricht.
Als Folge wird das Ausmaß an Delokalisierung verringert (und nicht vergrößert, so wie es ein Zuwachs an negativer Ladung eigentlich zuerst vermuten lässt), und es wird kürzerwelligeres, also energiereicheres Licht benötigt, um dieses System anzuregen: es findet eine Absorption von blauem Licht statt, der Farbeindruck erscheint gelb.
Von pH 1 bis pH 8 nimmt die Delokalisierung durch Wegnahme von Protonen und Erweiterungen des mesomeren Systems zu, die Anregung kann bei zunehmend längerwelligerem Licht stattfinden.
Der gelbe Farbstoff wandelt sich allerdings mit der Zeit in einen irreversiblen aber ebenso gelben Farbstoff um, der sich durch Zugabe von starken Laugen und Erzeugung von pH-Werten ≥ 10 rasch ausbildet.
Bei der Umwandlung wird der Pyranring aufgebrochen (Ringöffnung zum Chalkon). Die dadurch entstehende positive Ladung wird durch Anlagerung eines Hydroxyd-Ions ausgeglichen, wobei sich der Pyranring verdreht und eine Rückreaktion nicht mehr möglich ist. Dieses nun weniger aromatisierte System bedingt die Absorption von energiereichem Licht und den gelben Farbeindruck.
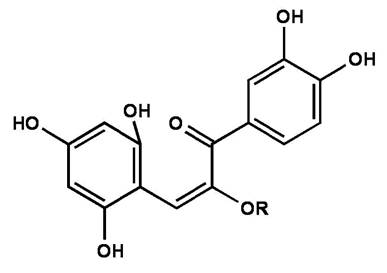
Abb. 10
Erstellt mit Hilfe des Programms C-Design_3
Chalkon
Enthält eine Pflanze Anthocyane, dann kann jedoch von ihrer Farbe ausgehend nicht automatisch auf den in der Pflanze vorliegenden pH-Wert geschlossen werden. So enthält die blaue Kornblume, wie auch rote Rosen und Rotkohl Cyanidin, in der Pflanze aber liegt ein pH-Wert von 4,6 vor. Die blaue Blütenfarbe rührt also nicht vom pH-Wert her, sondern von einem anderen Effekt:
Anthocyane bilden mit Aluminium und Eisenionen intensiv gefärbte Komplexe, wie zum Beispiel bei der Kornblume in Form eines bläulichen Cyanin-Eisen-Aluminium-Komplexes.
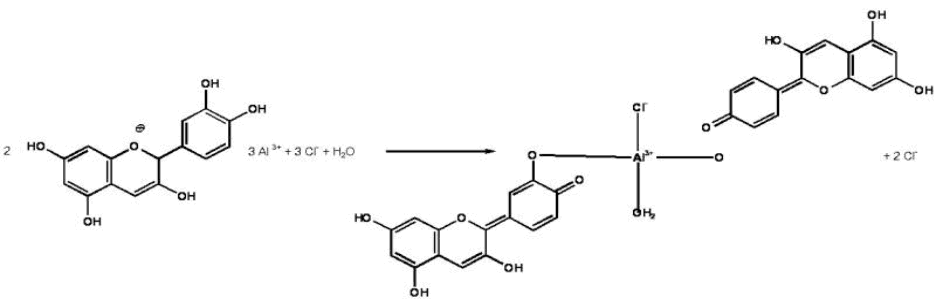
Abb. 11
Erstellt mit Hilfe des Programms C-Design_3
Bildung des Komplexes des Cyanidins mit Aluminium(III)chlorid
Zusätzlich zu den Säure-Base- und Komplexbildungsreaktionen geht der Hauptfarbstoff des Rotkohls auch Redoxreaktionen ein.
So wird Rotkohlsaft zum Beispiel unter Zugabe von Natriumhydrogensulfit (NaHSO3) oder Natriumdithionit (Na2S2O4) durch Bildung von SO2 entfärbt, eine Zugabe von 3%iger Wasserstoffperoxidlösung (H2O2) bewirkt eine langsame Entfärbung.
Mit konzentrierter Salpetersäure kann Cyanidin zu Quercetin oxidiert werden.
Eine Reduktion führt zum sog. Catechin.
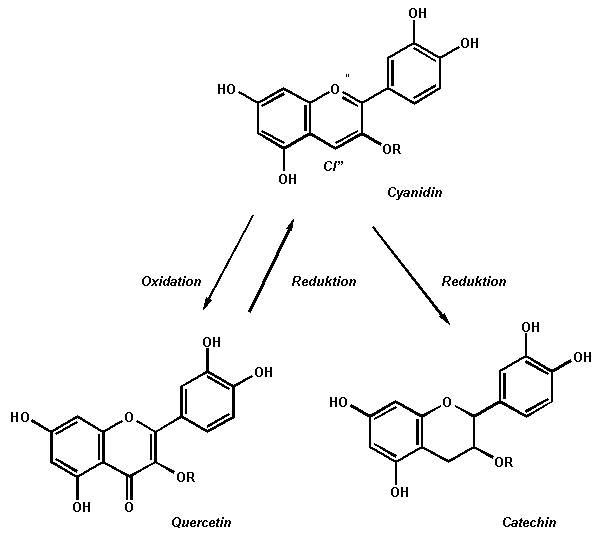
Abb. 12
Erstellt mit Hilfe des Programms C-Design_3
Redoxreaktionen des Cyanidins
Rotkohlsaft kann also als pH-Indikator zur Unterscheidung von sauren, neutralen und basischen Lösungen, sowie zur Erkennung der Wirkung von Oxidations- und Reduktionsmitteln verwendet werden.
Die Verrottung des Rotkohls (Zersetzung durch Bakterien und Schimmelpilze), lässt sich verlangsamen, wenn man den Kohlkopf im Gemüsefach des Kühlschranks aufbewahrt, und ihn bei angeschnittener Form in Haushaltsfolie wickelt. Auf diese Weise lässt er sich problemlos 14 Tage lagern.
Auch der extrahierte Saft ist im Kühlschrank lange ohne Schimmelbildung haltbar.
Der Saft verliert aber selbst beim Schimmeln seine Indikatorfähigkeit nicht. Zur Verwendung des Saftes sollten dann lediglich die Kolonien entfernt werden.
Erst nach Auftreten einer deutlichen Trübung, ist eine frische Herstellung des Saftes notwendig.
Der Geruch von alterndem Rotkohlsaft lässt sich jedoch nicht vermeiden.
| 1-8.2 Curcuma |
Curcuma, oder Gelbwurzel, gehört zu den Wurzel- und Rhizomgewürzen. Das Herkunftsland der Gelbwurzel ist nicht genau bekannt. Man vermutet, dass sie aus Südostasien stammt, wahrscheinlich sogar aus Ostindien. Es ist aber bekannt dass es über die Araber auf den europäischen Markt kam. Vom späten Mittelalter bis ins 20. Jahrhundert war Curcuma apothekenüblich. Bis in das 18. Jahrhundert wurde Curcuma als Arzneimittel gegen Pest verwendet.
Heute ist Curcuma ein Bestandteil von Gewürzen, vor allem von Curry, und ein viel genutzter Farbstoff in der Kosmetik.
Curcumin färbt Wolle, Baumwolle und Seide direkt grünlich-gelb, wendet man Alaun-Beize an so färbt Curcumin den Stoff orange-gelb. Als Textilfärbemittel hat es sich aber aufgrund seiner Unbeständigkeit im Alkalischen nicht durchsetzen können.
Curcuma ist ein orangegelbes kristallines Pulver, das sich zwar nicht in Wasser oder Ether, aber dafür in konzentrierter Essigsäure und Ethanol löst.
Curcumin ist eine aromatische Verbindung und entspricht dem Lebensmittelfarbstoff E 100.
Der chemische Name für Curcumin lautet:
Diferuloylmethan,1,7-Bis(4-hydroxy-3-methoxyphenyl)-1,6-heptadien-3,5-dion (C21H20O6), ein ungesättigtes Diketon mit zwei Guajacyl-Resten.
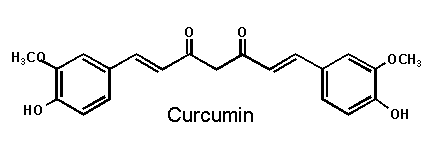
Abb. 13
Erstellt mit Hilfe des Programms C-Design_3
Curcumin ist sehr lichtempfindlich, aber relativ hitze- und säurestabil.
Seine gelbe Farbe ist ein Gemisch aus drei sehr ähnlichen gelben Farbstoffen, wobei Curcumin der Hauptbestandteil ist, die man durch die Dünnschichtchromatographie trennen kann. Bei den beiden anderen in Curcuma enthaltenen Farbstoffen handelt es sich zum einen um Demethoxycurcumin, welches zu 0,8 % in Curcuma enthalten ist, und zum anderen um Bisdemethoxycurcumin, dessen Gehalt in Curcuma 0,48 % beträgt.
Curcumin hat die Eigenschaft eines Säure-Base-Indikators. Es löst sich im Sauren mit hellgelber, im Alkalischen mit rotbrauner Farbe. Sein Umschlagsbereich liegt bei einem pH-Wert von 7,4 bis 8,6.
Es dient neben seiner pH-Empfindlichkeit zum Nachweis von Borsäure im salzsauren Medium, Titan und Zirkon. Alkalisch reagierende Borate färben sich in alkalischer Lösung in Anwesenheit von Curcumin grünschwarz.
| 2. Dokumentation der praktischen Arbeit im Labor | zum Seitenanfang  |
Auf der Suche nach einem natürlichen Indikator
| Teil 1: Experimente mit Rotkohl | zum Seitenanfang  |
| Teil 1-1: Auffinden eines geeigneten Extraktionsverfahrens zur Gewinnung von Rotkohlsaft | zum Seitenanfang  |
Da die obersten Schichten meist verschmutzt sind und der Kohl beim Waschen der Blätter bereits Farbstoff verliert, werden die äußeren Blätter des Kohls entfernt und dieser ungewaschen in kleine Stücke geschnitten.
 |
 |
| Abb. 14 (Bild: Mara Heyer / Katrin Wittwer) |
Abb. 15 (Bild: Mara Heyer / Katrin Wittwer) |
| Teil 1-1.1 Extraktionsversuche |
 Abb. 16 (Bild: Mara Heyer / Katrin Wittwer) |
Ein Abwiegen der Kohlstückchen, mit dem Ziel reproduzierbare Farbstoffmengen zu erhalten, erscheint nicht sehr sinnvoll, da die Farbstoffmenge von Kohl zu Kohl differiert und die Blätter unterschiedlich große Mengen an farbstofffreiem Strunk enthalten. Deshalb werden die eingesetzten Mengen in "Handvoll" angegeben.
Auswertung: Ergebnis:
|
| Teil 1-1.2 Konservierung des Rotkohls |
Möglichkeit
Aufbewahren der Stückchen in Frischhaltefolie im Kühlschrank.
→ zur Gewinnung von Lösung etwa 14 Tage verwendbarMöglichkeit
Rotkohlsaft im geschlossenen Gefäß im Kühlschrank lagern.
→ Ansätze von Schimmel können entfernt werden ohne, dass die Lösung verworfen werden muss. Erst dann nicht mehr verwendbar, wenn Trübung einsetzt.Möglichkeit
Einfrieren von Rotkohlsaft.
→ beliebige Haltbarkeit ohne merklichen Verlust der Farbstoffeigenschaften.Möglichkeit
Trocknen von Rotkohlstückchen bei 70 - 80°C im Trockenschrank oder stundenlang im Backofen und im Mörser verrieben. Bei Bedarf kann durch Kochen mit Wasser Extrakt gewonnen werden.
→ sehr zeit-, geduld- und energieaufwändige Methode, die verglichen mit den übrigen Methoden nicht die gewohnte Leuchtkraft an Farben liefert. Die Indikatoreigenschaft ist zwar noch vorhanden, die Farben erscheinen jedoch sehr schmutzig.
Abb. 18
(Bild: Mara Heyer / Katrin Wittwer)
 Abb. 19 (Bild: Mara Heyer / Katrin Wittwer) |
 Abb. 20 (Bild: Mara Heyer / Katrin Wittwer) |
 Abb. 21 (Bild: Mara Heyer / Katrin Wittwer) Aufgebrühter Rotkohlsaft links: alkalisch rechts: sauer |
 Abb. 22 (Bild: Mara Heyer / Katrin Wittwer) Rotkohlsaft im Sauren links: aufgebrühter Saft rechts: frischer Saft |
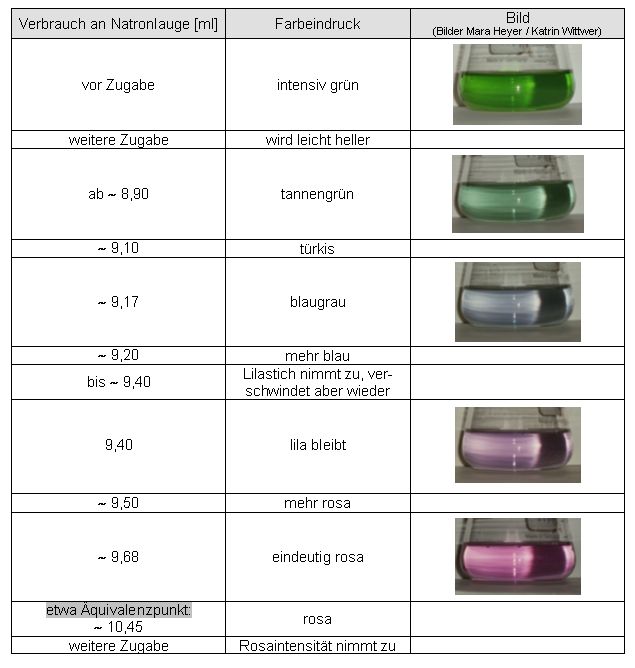
| Teil 1-2: Farbe des Rotkohlextraktes bei verschiedenen pH-Werten | zum Seitenanfang  |
Zehn Milliliter wässriger Rotkohlextrakt werden mit Salzsäure und Natronlauge unter Zuhilfenahme eines pH-Meters ungefähr auf folgende pH-Werte eingestellt: 1; 3; 5; 7; 9; 11; 13 (A entspricht dem wässrigem Extrakt zum Vergleich)

A 1 3 5 7 9 11 13
Abb. 23

Abb. 24
(Bilder: Mara Heyer / Katrin Wittwer)
Messwerte:
gemessener Eigen-pH-Wert des Rotkohlsaftes: 5,98

Auswertung und Ergebnis:
Der im Zellsaft des Rotkohls hauptsächlich vorkommende Farbstoff Cyanidin absorbiert abhängig vom pH-Wert der Lösung unterschiedliche Wellenlängen des sichtbaren Lichtes. Rotkohlsaft fungiert demnach als Universalindikator. Man kann ihn dazu verwenden, um Säuren von Basen zu unterscheiden (Säure-Base-Indikator).
Die dem Cyanidin zugrunde liegenden Strukturänderungen bei Wechsel des pH-Bereichs wurden im theoretischen Teil erläutert.
| Teil 1-3: Untersuchungen zur Haltbarkeit das Rotkohlsaftes | zum Seitenanfang  |
| Teil 1-3.1 Erster Versuch zur Verfolgung der Haltbarkeit des Rotkohlfarbstoffes |
Rotkohlextrakt absorbiert Licht ganz bestimmter Wellenlängen. Diese können mit Hilfe eines Absorptionsspektrums ermittelt werden. Bei der Wellenlänge des Absorptionsmaximums lässt sich die Extinktion einer Lösung am genauesten verfolgen.
Mit diesem Wissen entstand die Idee, dass wenn sich der Farbstoff zersetzt, sich die Extinktion des Extraktes bei der Wellenlänge des Absorptionsmaximums, sowie der pH-Wert der Lösung, aufgrund der Zersetzung verändern müssten.
Als Blindprobe wurde demin. Wasser verwendet.
Messwerte:
Verwendung des Rotkohlextraktes aus 2. (Farbe des Rotkohlextraktes bei verschiedenen pH-Werten)
| pH-Wert = 5,98 | Verdünnung in etwa 1:10 |
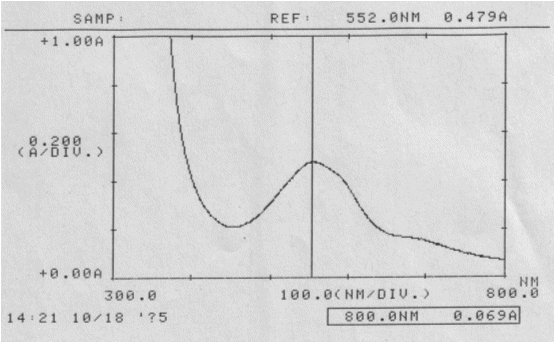
Abb.25
Reiner Rotkohlsaft; gemessen am 18.10.05
Absorptionsspektrum
Auswertung:
Wellenlänge des Absorptionsmaximums:
λmax = 552 nm
Messwerte der Haltbarkeitsreihe:
1 ml Rotkohlsaft auf 10 ml verdünnt
Untersucht werden sollte die Abhängigkeit der Haltbarkeit vom Einfluss des Lichtes, die Lösung wurde deswegen halbiert und in verschieden lichtdurchlässigen Gefäßen im Kühlschrank aufbewahrt.
Dabei wurde jedoch nicht bedacht, dass dort auch das Weißglas kein Licht erfährt.
Auswertung:
Die Extinktion des Rotkohlsaftes bei der maximalen Wellenlänge nahm zu.
Ergebnis:
Die Messreihe ist aufgrund mangelnder Kenntnisse nicht auswertbar.
| Teil 1-3.2 Zweiter Versuch zur Verfolgung der Haltbarkeit des Rotkohlfarbstoffes |
Zum Zeitpunkt der vorhergehenden Versuchsreihe war das Phänomen des isosbestischen Punktes noch nicht bekannt (zum isosbestischen Punkt siehe theoretische Abhandlung).
In der nun folgenden Versuchsreihe sollte die Haltbarkeit einer Rotkohllösung und somit die Konzentration ihres Farbstoffes durch Messung der Extinktion am isosbestischen Punkt verfolgt und somit die Zersetzung belegt werden.
Bei der Messung der Extinktion am isosbestischen Punkt sollte die Abhängigkeit der Haltbarkeit des Rotkohlfarbstoffes von Lichteinwirkung und von Kühlung berücksichtigt werden.
Probe 1: dunkle und kühle Aufbewahrung des Saftes
Probe 2: dunkle Aufbewahrung des Saftes bei Raumtemperatur
Probe 3: Aufbewahrung des Saftes an Tageslicht bei Raumtemperatur
Zur Ermittlung des isosbestischen Punktes wurden die Absorptionsspektren von Rotkohllösungen unterschiedlichen pH-Wertes gemessen (sauer, neutral, basisch).
Die unterschiedlichen pH-Werte wurden mit verdünnter Salzsäure und verdünnter Natronlauge eingestellt.
Messwerte:
Erster Versuch: 25 ml Rotkohlsaft auf ca. 200 ml verdünnt (pH = 6,43)
Jeweils ein Drittel der Lösung mit Hilfe von verdünnter Salzsäure und verdünnter Natronlauge angesäuert, neutralisiert und alkalisiert. Von allen drei Lösungen wurde ein Absorptionsspektrum erstellt.
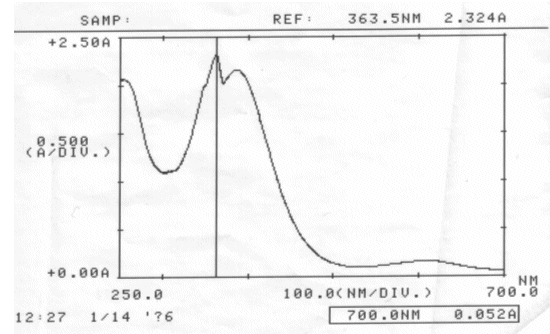 Abb. 26 Rotkohl alkalisch; gemessen am 14.01.06 Absorptionsspektrum |
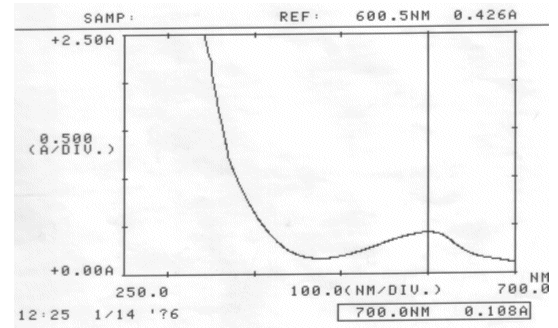 Abb. 27 Rotkohl neutral; gemessen am 14.01.06 Absorptionsspektrum |
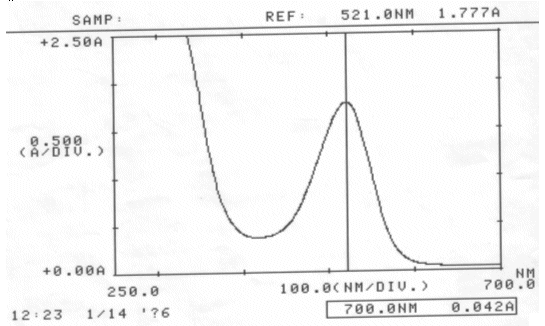 Abb. 28 Rotkohl sauer; gemessen am 14.01.06 Absorptionsspektrum |
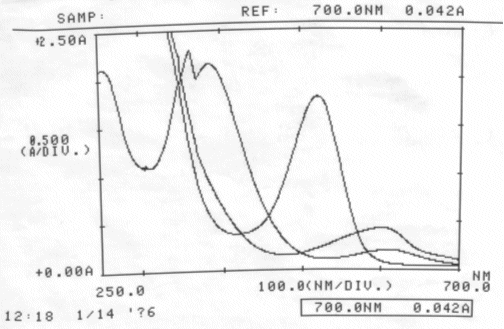 Abb. 29 Rotkohl: neutral, sauer, basisch; gemessen am 14.01.06 Absorptionsspektrum |
Auswertung:
| λmax(alkalische Rotkohllösung) | = | 363,5 nm |
| λmax(neutrale Rotkohllösung) | = | 600,5 nm → falsches λmax, es ist jenes im VIS-Bereich zu ermitteln |
| λmax(saure Rotkohllösung) | = | 521,0 nm |
Kein isosbestischer Punkt ermittelbar, da die drei Kurven sich nicht gemeinsam in einem Punkt schneiden.
Ergebnis:
Es konnte kein isosbestischer Punkt gefunden werden und deswegen wurde zu diesem Zeitpunkt der Untersuchungen ein fehlerhaftes Vorgehen vermutet.
Aus diesem Grund:
Neuer Versuch
Messwerte:

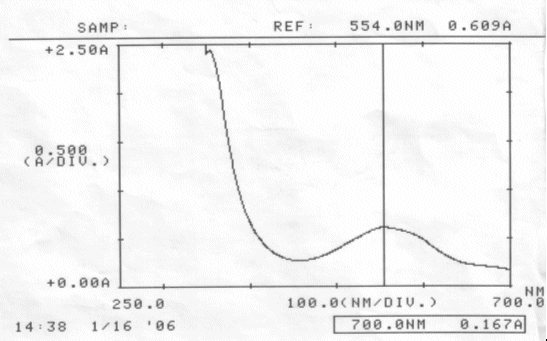 Abb. 30 Reiner Rotkohlsaft; gemessen am 16.01.06 Absorptionsspektrum |
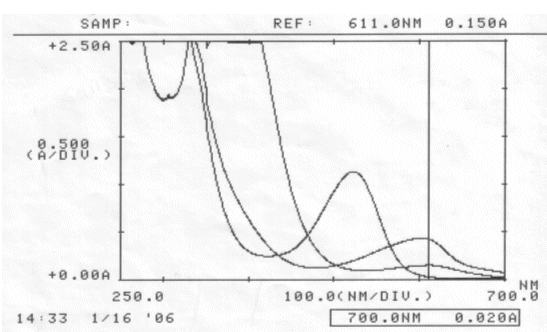 Abb. 31 Rotkohl: neutral, sauer, basisch; gemessen am 16.01.06 Absorptionsspektrum |
Auswertung:
Es konnte erneut kein isosbestischer Punkt ermittelt werden.
Beim genaueren Nachdenken entstand folgender Erklärungsversuch:
Ein isosbestischer Punkt beruht auf der Beständigkeit des pH-abhängigen Farbstoffes. Cyanidin verliert jedoch laut Literatur mit steigendem pH-Wert an Stabilität. Das bedeutet, dass sich der eigentliche Farbstoff zersetzt und somit kein isosbestischer Punkt bestehen kann.
Bei Messung des reinen Rotkohlsaftes, wurde ein Absorptionsmaximum von 554 nm gefunden. Mit diesem Saft sollte ursprünglich die Haltbarkeitsreihe am isosbestischen Punkt durchgeführt werden.
Ergebnis:
Die Verfolgung der Zersetzung des Rotkohlfarbstoffes an einem isosbestischen Punkt ist wegen dessen fehlenden Vorhandenseins nicht möglich.
| Teil 1-3.3 Dritter Versuch zur Verfolgung der Haltbarkeit des Rotkohlfarbstoffes |
Rotkohlextrakt absorbiert Licht ganz bestimmter Wellenlängen. Diese können mit Hilfe eines Absorptionsspektrums ermittelt werden. Wenn sich der Farbstoff zersetzt, müsste sich die Wellenlänge des Absorptionsmaximums verschieben.
Messwerte:
Verwendet wurde frisch hergestellter Rotkohlsaft
Messung vom 28.01.06

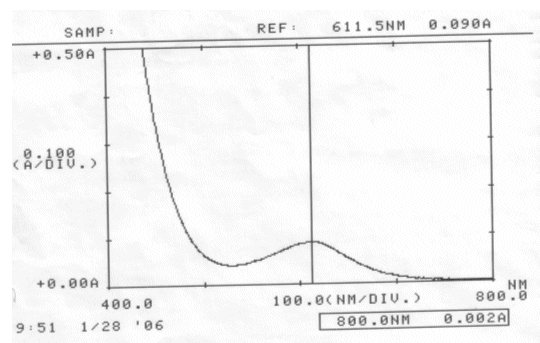 Abb. 32 Rotkohl alkalisch; gemessen am 28.01.06 Absorptionsspektrum |
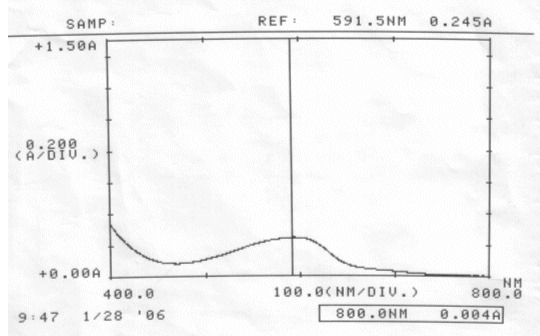 Abb. 33 Rotkohl neutral; gemessen am 28.01.06 Absorptionsspektrum |
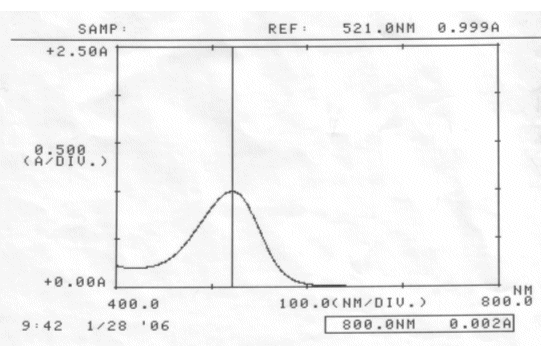 Abb. 34 Rotkohl sauer; gemessen am 28.01.06 Absorptionsspektrum |
|
Messung vom 30.01.06 mit denselben Lösungen:

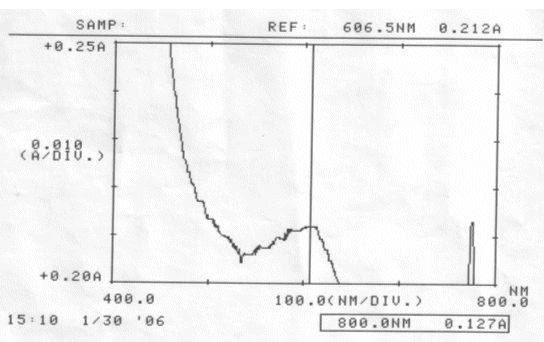 Abb. 35 Rotkohl alkalisch; gemessen am 30.01.06 Absorptionsspektrum |
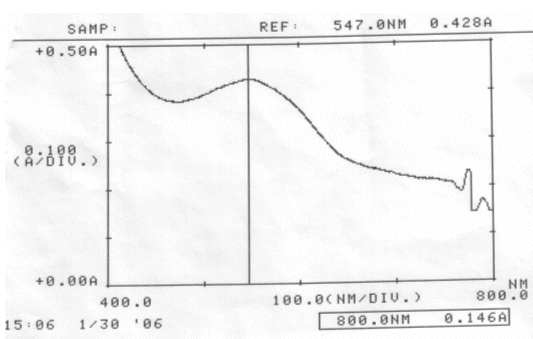 Abb. 36 Rotkohl neutral; gemessen am 30.01.06 Absorptionsspektrum |
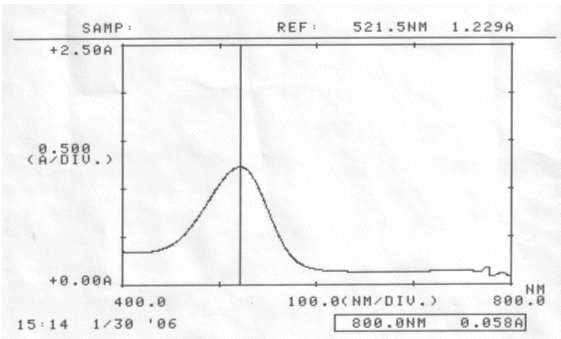 Abb. 37 Rotkohl sauer; gemessen am 30.01.06 Absorptionsspektrum |
|
Auswertung:
Im sauren Bereich blieben pH-Wert als auch Absorptionsmaximum des Farbstoffes erhalten. Die erhöhte Extinktion nach Ablauf von zwei Tagen kann nicht erklärt werden.
Im neutralen scheint sich der Farbstoff zu verändern, eventuell sogar zu zersetzen. Darauf deuten die Verschiebung des Absorptionsmaximums und der veränderte pH-Wert hin. Allerdings kann keine Aussage darüber gemacht werden, ob der Farbstoff einfach nur durch einen nicht bekannten Vorgang protoniert wurde, oder Zersetzungsprodukte entstanden sind.
Gleiches Phänomen konnte bei der alkalisch angesetzten Lösung beobachtet werden.
Ergebnis:
Der Farbstoff Cyanidin ist im Sauren am Beständigsten.
Schon im neutralen Bereich finden farbstoff-verändernde Reaktionen statt.
Um einen möglichst lang haltbaren Rotkohlsaft gleicher Ausgangskonzentration zu erhalten, empfiehlt es sich ihn angesäuert aufzubewahren.
| Teil 1-4: Überprüfung der Eignung von Rotkohlsaft zur Endpunktsindikation einer Neutralisationstitration | zum Seitenanfang  |
| Teil 1-4.1 Verfolgung des Farbverlaufes während einer Titration in Abhängigkeit verschiedener Faktoren |
Teil 1-4.1.1
Abhängigkeit des Farbverlaufes unter Verwendung von Rotkohlsäften unterschiedlichen Herstellungsdatums
Zweck:
Verschaffen eines Überblickes über den Farbverlauf während der Titration einer starken Säure mit einer starken Base und umgekehrt
A
| Messwerte: | |
| Vorlage: | 10,00 ml ~ 0,1 M Salzsäure t = 1,2168 |
| Maßlösung: | ~ 0,1 M Natronlauge t = 1,0000 |
| theoretischer Endpunkt: | cNaOH • VNaOH • tNaOH = cHCl • VHCl • tHCl |
| daraus folgt: | VNaOH = (cHCl • VHCl • tHCl) / (cNaOH • tNaOH) VNaOH = 12,17 ml |
| Titrationsgeschwindigkeit: | langsam (Farbverläufe fotografiert) gleich nach Indikatorzugabe titriert |
| Indikator: | 1. Vorgekochter Saft (eine Woche alt) 2. gleicher Kohl, aber am Versuchstag gekocht |
| Menge an Indikator: | 2 ml |
| Farbe der Ausgangslösung: | |


Umschlagspunkt:
Abb. 39
(Bilder Mara Heyer / Katrin Wittwer)
B
| Messwerte: | |
| Vorlage: | 10,00 ml ~ 0,1 M Natronlauge t = 1,0000 |
| Maßlösung: | ~ 0,1 M Salzsäure t = 1,2168 |
| theoretischer Endpunkt: | cNaOH • VNaOH • tNaOH = cHCl • VHCl • tHCl |
| daraus folgt: | VHCl = (cNaOH • VNaOH • tNaOH) / (cHCl • tHCl) VHCl = 8,22 ml |
| Titrationsgeschwindigkeit: | langsam (Farbverläufe fotografiert) gleich nach Indikatorzugabe titriert |
| Indikator: | 1. Vorgekochter Saft (eine Woche alt) 2. gleicher Kohl, aber am Versuchstag gekocht |
| Menge an Indikator: | 2 ml |
| Farbe der Ausgangslösung: | |

Umschlagspunkt:
Abb.41
(Bilder Mara Heyer / Katrin Wittwer)
Auswertung:
Mit diesen Titrationen wurde sich ein erster Überblick über den Farbverlauf des Rotkohlsaftes verschafft.
Sowohl bei der Titration von Salzsäure, als auch bei der Titration von Natronlauge liegen am Äquivalenzpunkt keine definierten Umschläge vor. Bei Titration der Salzsäure erfolgt ein Umschlag zu früh, bei Titration der Natronlauge zu spät.
Zudem wurde beide Male ein farblicher Unterschied zwischen vorgekochtem und frisch gekochtem Saft festgestellt.
Lässt man die Natronlaugelösung mit Rotkohlsaft zu lange stehen, verändert sie ihre Farbe nach gelb und es ergeben sich andere Farbverläufe bei der Titration.
Ergebnis:
Es besteht eine Abhängigkeit des Farbverlaufs bei der Titration mit Rotkohl von dessen Zusammensetzung, bzw. Konzentration.
Ein erster Überblick ergab vom Äquivalenzpunkt abweichende Umschlagspunkte.
Teil 1-4.1.2
Abhängigkeit des Farbverlaufes von Konzentration des zugegebenen Rotkohlextraktes, bzw. Maß an Verdünnung der Probelösung und von der Titrationsgeschwindigkeit
A Titration starker Säure mit starker Base
Messwerte:
1. Versuch
| Vorlage: | 10,00 ml ~ 0,1 M Salzsäure t = 1,2069 |
| Maßlösung: | ~ 0,1 M Natronlauge t = 0,9960 |
| theoretischer Endpunkt: | cNaOH • VNaOH • tNaOH = cHCl • VHCl • tHCl |
| daraus folgt: | VNaOH = (cHCl • VHCl • tHCl) / (cNaOH • tNaOH) VNaOH = 12,12 ml |
| Titrationsgeschwindigkeit: | sehr langsam (Farbverläufe fotografiert) gleich nach Indikatorzugabe titriert |
| Indikator: | |
| Menge an Indikator: | 0,5 ml (frisch hergestellt) |
| Verdünnung mit demin. Wasser: | + 89,5 ml |
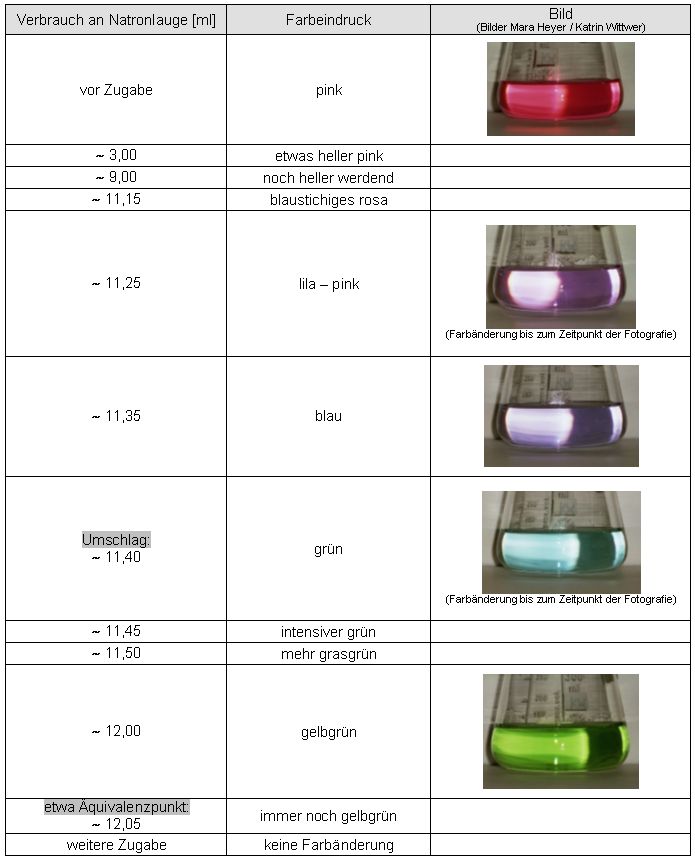
Auswertung:
Ein definierter Umschlag (blau nach grün) erfolgte zu früh.
Abweichung des ermittelten Endpunktes vom Äquivalenzpunkt:
12,12 ml - 11,40 ml = 0,72 ml
12,12 ml → 100 %
0,72 ml → 5,9%
2. Versuch
| Vorlage: | 10,00 ml ~ 0,1 M Salzsäure t = 1,2069 |
| Maßlösung: | ~ 0,1 M Natronlauge t = 0,9960 |
| theoretischer Endpunkt: | cNaOH • VNaOH • tNaOH = cHCl • VHCl • tHCl |
| daraus folgt: | VNaOH = (cHCl • VHCl • tHCl) / (cNaOH • tNaOH) VNaOH = 12,12 ml |
| Titrationsgeschwindigkeit: | schnell gleich nach Indikatorzugabe titriert |
| Indikator: | |
| Menge an Indikator: | 0,5 ml (frisch hergestellt) |
| Verdünnung mit demin. Wasser: | + 89,5 ml |
Auswertung:
Es erfolgte kein so scharfer Umschlag wie in Versuch 1, wieder jedoch lag er weit vor dem Äquivalenzpunkt.
Abweichung des ermittelten Endpunktes vom Äquivalenzpunkt:
12,12 ml - 11,40 ml = 0,72 ml
12,12 ml → 100 %
0,72 ml → 5,9%
3. Versuch
| Vorlage: | 10,00 ml ~ 0,1 M Salzsäure t = 1,2069 |
| Maßlösung: | ~ 0,1 M Natronlauge t = 0,9960 |
| theoretischer Endpunkt: | cNaOH • VNaOH • tNaOH = cHCl • VHCl • tHCl |
| daraus folgt: | VNaOH = (cHCl • VHCl • tHCl) / (cNaOH • tNaOH) VNaOH = 12,12 ml |
| Titrationsgeschwindigkeit: | schnell erst nach 15 Minuten titriert |
| Indikator: | |
| Menge an Indikator: | 0,5 ml (frisch hergestellt) |
| Verdünnung mit demin. Wasser: | + 89,5 ml |

Auswertung:
Erneut kein so scharfer Umschlag, jedoch diesmal noch früher, als die letzten beiden Male.
Abweichung des ermittelten Endpunktes vom Äquivalenzpunkt:
12,12 ml - 11,31 ml = 0,77 ml
12,12 ml → 100 %
0,77 ml → 6,4%
4. Versuch
| Vorlage: | 10,00 ml ~ 0,1 M Salzsäure t = 1,2069 |
| Maßlösung: | ~ 0,1 M Natronlauge t = 0,9960 |
| theoretischer Endpunkt: | cNaOH • VNaOH • tNaOH = cHCl • VHCl • tHCl |
| daraus folgt: | VNaOH = (cHCl • VHCl • tHCl) / (cNaOH • tNaOH) VNaOH = 12,12 ml |
| Titrationsgeschwindigkeit: | schnell gleich nach Indikatorzugabe titriert |
| Indikator: | |
| Menge an Indikator: | 0,5 ml (frisch hergestellt) |
| Verdünnung mit demin. Wasser: | ~ auf 100 ml aufgefüllt |

Auswertung:
Der Umschlag war erneut nicht sehr gut erkennbar, und erfolgte wiederum viel zu früh.
Abweichung des ermittelten Endpunktes vom Äquivalenzpunkt:
12,12 ml - 11,31 ml = 0,77 ml
12,12 ml → 100 %
0,77 ml → 6,4 %
5. Versuch
| Vorlage: | 10,00 ml ~ 0,1 M Salzsäure t = 1,2069 |
| Maßlösung: | ~ 0,1 M Natronlauge t = 0,9960 |
| theoretischer Endpunkt: | cNaOH • VNaOH • tNaOH = cHCl • VHCl • tHCl |
| daraus folgt: | VNaOH = (cHCl • VHCl • tHCl) / (cNaOH • tNaOH) VNaOH = 12,12 ml |
| Titrationsgeschwindigkeit: | sehr langsam (Farbverläufe fotografiert) gleich nach Indikatorzugabe titriert |
| Indikator: | |
| Menge an Indikator: | 2 ml (frisch hergestellt) |
| Verdünnung mit demin. Wasser: | + 88,0 ml |
Auswertung:
Wiederum wenig scharfer und zu früh erfolgter Umschlag.
12,12 ml - 11,60 ml = 0,52 ml
12,12 ml → 100 %
0,52 ml → 4,3%
Ergebnis Versuche 1-5:
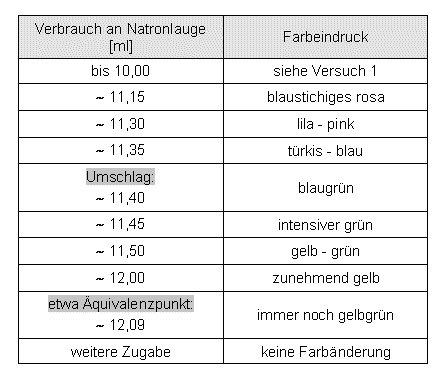
Bei der Titration von Salzsäure mit Rotkohlsaft als Indikator findet ein Umschlag (vom bläulichen ins grünliche) generell 4-7 % vor dem Äquivalenzpunkt statt. Das sind entschieden zu hohe Werte für eine Titration.
Bei so wenigen Titrationen konnte kein signifikanter Unterschied im Farbverlauf zwischen schneller, langsamer und nach15 Minuten begonnener Titration festgestellt werden.
Mehr Indikatorzusatz jedoch führte zu kräftigeren Farbtönen und zum kleinsten Indikatorfehler.
Zum Belegen dieser Thesen wären jedoch wiederholte Versuche von Nöten gewesen.
B Titration starker Base mit starker Säure
Messwerte:
1. Versuch
| Vorlage: | 10,00 ml ~ 0,1 M Natronlauge t = 1,1692 |
| Maßlösung: | ~ 0,1 M Salzsäure t = 1,1223 |
| theoretischer Endpunkt: | cNaOH • VNaOH • tNaOH = cHCl • VHCl • tHCl |
| daraus folgt: | VHCl = (cNaOH • VNaOH • tNaOH) / (cHCl • tHCl) VHCl = 10,42 ml |
| Titrationsgeschwindigkeit: | sehr langsam (Farbverläufe fotografiert) gleich nach Indikatorzugabe titriert |
| Indikator: | |
| Menge an Indikator: | 0,5 ml (frisch hergestellt) |
| Verdünnung mit demin. Wasser: | + 89,5 ml |

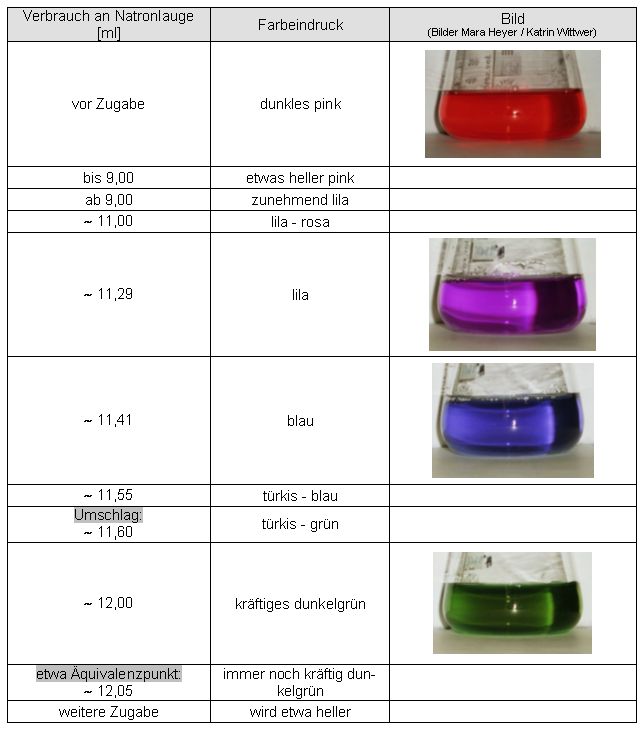
Auswertung:
Abweichung des ermittelten Endpunktes vom Äquivalenzpunkt:
10,42 ml - 9,30 ml = 1,12 ml
10,42 ml → 100 %
1,12 ml → 10,7 %
2. Versuch
| Vorlage: | 10,00 ml ~ 0,1 M Natronlauge t = 1,1692 |
| Maßlösung: | ~ 0,1 M Salzsäure t = 1,1223 |
| theoretischer Endpunkt: | cNaOH • VNaOH • tNaOH = cHCl • VHCl • tHCl |
| daraus folgt: | VHCl = (cNaOH • VNaOH • tNaOH) / (cHCl • tHCl) VHCl = 10,42 ml |
| Titrationsgeschwindigkeit: | schnelle Titration gleich nach Indikatorzugabe titriert |
| Indikator: | |
| Menge an Indikator: | 0,5 ml (frisch hergestellt) |
| Verdünnung mit demin. Wasser: | + 89,5 ml |
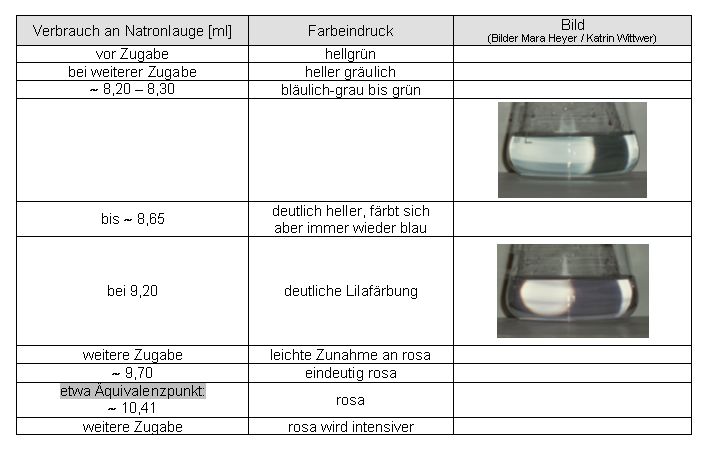
Auswertung:
kein eindeutiger Endpunkt ermittelbar.
3. Versuch
| Vorlage: | 10,00 ml ~ 0,1 M Natronlauge t = 1,1692 |
| Maßlösung: | ~ 0,1 M Salzsäure t = 1,1223 |
| theoretischer Endpunkt: | cNaOH • VNaOH • tNaOH = cHCl • VHCl • tHCl |
| daraus folgt: | VHCl = (cNaOH • VNaOH • tNaOH) / (cHCl • tHCl) VHCl = 10,42 ml |
| Titrationsgeschwindigkeit: | schnell erst nach 30 Minuten titriert |
| Indikator: | |
| Menge an Indikator: | 0,5 ml (frisch hergestellt) |
| Verdünnung mit demin. Wasser: | + 89,5 ml |
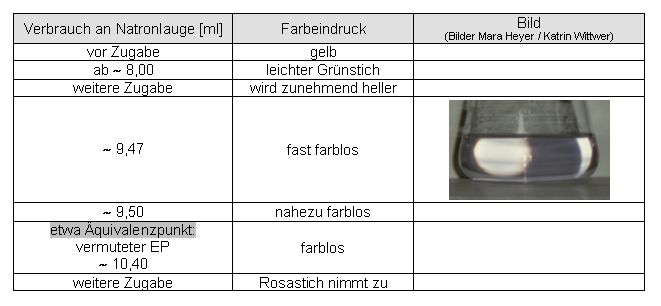
Auswertung:
Abweichung des ermittelten Endpunktes vom Äquivalenzpunkt:
10,42 ml - 10,40 ml = 0,02 ml
10,42 ml → 100 %
0,02 ml → 0,2 %
4. Versuch
| Vorlage: | 10,00 ml ~ 0,1 M Natronlauge t = 1,1692 |
| Maßlösung: | ~ 0,1 M Salzsäure t = 1,1223 |
| theoretischer Endpunkt: | cNaOH • VNaOH • tNaOH = cHCl • VHCl • tHCl |
| daraus folgt: | VHCl = (cNaOH • VNaOH • tNaOH) / (cHCl • tHCl) VHCl = 10,42 ml |
| Titrationsgeschwindigkeit: | schnell gleich nach Indikatorzugabe titriert |
| Indikator: | |
| Menge an Indikator: | 0,5 ml (frisch hergestellt) |
| Verdünnung mit demin. Wasser: | auf ungefähr 100 ml |

Auswertung:
kein eindeutiger Endpunkt ermittelbar.
5. Versuch
| Vorlage: | 10,00 ml ~ 0,1 M Natronlauge t = 1,1692 |
| Maßlösung: | ~ 0,1 M Salzsäure t = 1,1223 |
| theoretischer Endpunkt: | cNaOH • VNaOH • tNaOH = cHCl • VHCl • tHCl |
| daraus folgt: | VHCl = (cNaOH • VNaOH • tNaOH) / (cHCl • tHCl) VHCl = 10,42 ml |
| Titrationsgeschwindigkeit: | sehr langsam (Farbverläufe fotografiert) gleich nach Indikatorzugabe titriert |
| Indikator: | |
| Menge an Indikator: | 2 ml (frisch hergestellt) |
| Verdünnung mit demin. Wasser: | + 88,0 ml |
Auswertung:
kein eindeutiger Endpunke ermittelbar.
Ergebnis Versuche 1-5:
Bei der Titration von Natronlauge mit Rotkohlsaft als Indikator sind die Farbverläufe stark abhängig vom Zeitraum der Indikatorzugabe bis zum Titrationsende sowie von der Menge an zugegebenem Indikator. Dies beruht vermutlich auf der Instabilität des Cyanidins im basischen Milieu, bei der die Bildung des irreversiblen gelben Farbstoffes stattfindet.
Fazit:
Für die Titration starker Base mit starker Säure ist Rotkohlsaft als Indikator wegen der Zersetzungseigenschaft seines Farbstoffes im alkalischen Milieu ungeeignet.
| Teil 1-5: Irreversibilität des gelben Farbstoffes | zum Seitenanfang  |
100 ml demin. Wasser werden mit 10 ml Rotkohllösung versetzt, so dass die Lösung gut farbig ist.
Anschließend wird verdünnte Natronlauge zugetropft, bis eine gelbe Lösung vorliegt.
- Durch Zugabe von verdünnter Salzsäure wird überprüft, ob es sich um den reversiblen oder irreversiblen Farbstoff handelt.
- Die Lösung wird vor Zugabe der verdünnten Salzsäure eine halbe Stunde stehengelassen.
- Die Lösung wird vor Zugabe der verdünnten Salzsäure eine Stunde stehengelassen. Ist die Lösung nach einer Stunde immer noch reversibel, so wird im Halbstundentakt mit verdünnter Salzsäure überprüft.
- Die Lösung wird mit Natriumhydroxid-Plätzchen auf pH 14 gebracht und anschließend mit verdünnter Salzsäure versetzt.
Messwerte:
Verwendet wurde der am 18.10.05 eingefrorene Rotkohlextrakt, wobei die Eiswürfel im lauwarmen Wasserbad aufgetaut wurden.
pH-Wert 6,50
Farbe dunkellila
Erst ab pH 12 konnte eine Gelbfärbung festgestellt werden, wobei allerdings noch ein deutlicher Grünstich erkennbar war.
- Unter Zugabe von verdünnter Salzsäure färbte sich die Lösung wieder rot.
- Im Verlauf der halben Stunde Wartezeit färbte sich die Lösung rein gelb. Es musste viel verdünnte Salzsäure zugegeben werden bis sich die Lösung leicht rot färbte.
Tabelle für c) und d):

Anmerkung:
Die gelbe Lösung besteht rein aus irreversiblem Farbstoff, wenn sich die Lösung unter Zugabe von Salzsäure nicht mehr verändert und gelb bleibt.
Auswertung und Ergebnis:
Eine Zersetzung des reversiblen gelben Farbstoffes in einen irreversiblen gelben Farbstoff konnte dadurch nachgewiesen werden, dass nach längerer Standzeit bei Zusatz von Salzsäure nur noch eine schwache Rosafärbung erzielbar war.
Der Zersetzungsprozess scheint sich jedoch über einen längeren Zeitraum zu vollziehen, da selbst nach fünf Stunden Standzeit der alkalischen Lösung noch leichte Reversibilität feststellbar war.
| Teil 1-6: Herstellung von Indikatorpapier | zum Seitenanfang  |
 Abb. 62 (Bild: Mara Heyer / Katrin Wittwer) |
Einzelne Filterpapierstreifen werden in einen recht konzentrierten Rotkohlsaft getaucht, getrocknet (an Luft oder im Trockenschrank bei bis zu 80°C) und der Vorgang so oft wiederholt bis die gewünschte Farbintensität vorliegt. Das Indikatorpapier zeigt nun wie der Rotkohlsaft selbst beim Eintauchen in die zu untersuchende Lösung die jeweilige saure, neutrale oder basische Wirkung an. |
| Teil 1-7: Untersuchung der Komplexbildung von Cyanidin mit Eisen- und Aluminiumionen | zum Seitenanfang  |
3 ml Rotkohlsaft werden mit dem entsprechenden Metallsalz (ein bis zwei Spatelspitzen) versetzt, mit demin. Wasser versetzt und so lange geschüttelt bis das Salz gelöst ist. Dann wird die Lösung geteilt und die eine mit verdünnter Salzsäure (~ 0,1 M) angesäuert und die andere mit verdünnter Natronlauge (~ 0,1 M) alkalisiert.
Verwendete Salze:
FeCl3 • 6 H2O
AlK(SO4)2 • 12 H2O
Eisen(III)-Salz
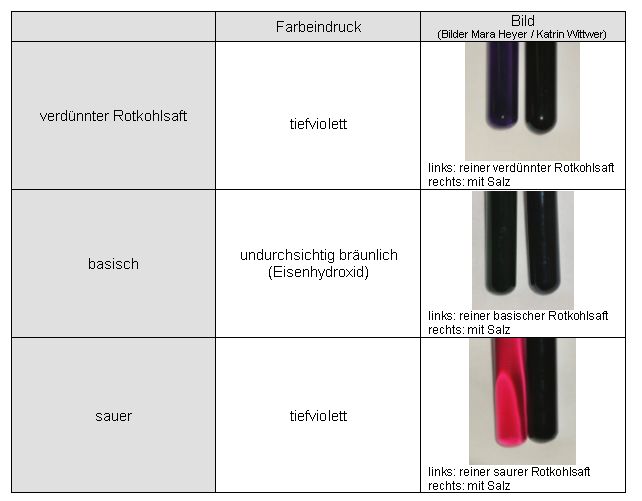
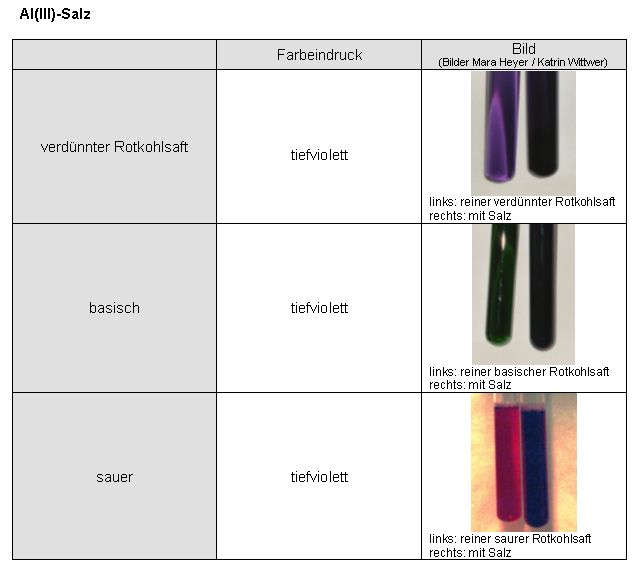
Auswertung:
Sowohl beim Eisen-, als auch beim Aluminiumsalz erhält man in Kombination mit Rotkohlsaft undurchsichtige tiefviolette Färbungen.
Auch beim Alkalisieren oder Ansäuern scheint der Komplex erhalten zu bleiben.
Die Braunfärbung beim Eisenkomplex in basischer Lösung ist auf ausgefälltes Eisenhydroxid zurückzuführen.
Ergebnis:
Das Cyanidin im Rotkohlsaft bildet mit Eisen(III)-Salzen und Aluminium(III)-Salzen intensiv gefärbte Komplexe.
| Teil 1-8: Redoxreaktionen von Cyanidin | zum Seitenanfang  |
3 ml Rotkohlsaft werden mit demin. Wasser im Reagenzglas etwas verdünnt und die Farbreaktion bei Zugabe von Reduktionsmittel bzw. Oxidationsmittel beobachtet.
Messwerte:
- Zugabe von 3 Spatelspitzen Dithionit
leichte Gasentwicklung und rote Lösung - Zugabe von 6 Spatelspitzen Peroxodisulfat
Nach langem Schütteln Aufhellung bis nur noch leichte Blaufärbung erkennbar. - Zugabe von 2 1/2 Pasteurpipetten 33 %igem Wasserstoffperoxid nach langem Schütteln und warten Entfärbung der Lösung
Auswertung:
- Dithionit ist ein Reduktionsmittel. Die Reduktionseigenschaft scheint in diesem Fall nicht so stark ausgeprägt gewesen zu sein, da sich der Farbstoff nicht aufhellte. Allerdings scheint sich wohl ein saures Milieu gebildet zu haben, da sich die Lösung rot färbte.
- Peroxodisulfat ist ein starkes Oxidationsmittel, welches Cyanidin zerstört und somit die Aufhellung verursacht.
- Wasserstoffperoxid wirkt im Rotkohlsaftmilieu (leicht sauer) oxidierend, wodurch das Cyanidin zerstört wird und eine Aufhellung bewirkt wird.
Ergebnis:
Cyanidin geht Redoxreaktionen ein.
 Abb. 69 Zu 2. links: reiner Rotkohlsaft rechts: mit Salz |
 Abb. 70 Zu 3. links: reiner Rotkohlsaft rechts: mit Salz |
| Teil 2: Experimente mit Curcuma | zum Seitenanfang  |
| Teil 2-1: Auffinden eines geeigneten Extraktionsverfahrens zur Gewinnung von Curcumaextrakt | zum Seitenanfang  |
| Teil 2-1.1 Extraktionsversuche |
 Abb. 71 Curcuma © Nataraja; Quelle: http://commons.wikimedia.org/wiki/Image:Curcuma.jpg |
|
Beobachtung:
-
leicht gelb gefärbte Lösung nach filtrieren


Abb. 72 und 73
(Bilder Mara Heyer / Katrin Wittwer)
gekocht vor filtrieren -
intensiver gelb gefärbte, aber leicht getrübte Lösung nach filtrieren


Abb. 74
(Bilder Mara Heyer / Katrin Wittwer)
Vergleich: ungekochter wässriger Auszug (links) und gekochter wässriger Auszug (rechts)Abb. 75
(Bilder Mara Heyer / Katrin Wittwer)
Vergleich: ungekochter wässriger Auszug (links), gekochter wässriger Auszug (Mitte) und ethanolischer Auszug (rechts) sofort intensive Gelbfärbung nach Zugabe von Ethanol
nach Filtrieren intensiv gelb leuchtende klare Lösung
Auswertung:
Durch das Kochen der wässrigen Aufschlämmung kann man intensiver gefärbte Lösungen gewinnen, die allerdings eine deutlich sichtbare Trübung aufweisen.
Ergebnis:
Will man schnell und ohne großen Aufwand einen klaren und intensiv gefärbten Curcumaextrakt, so empfiehlt sich Ethanol als Extraktionsmittel.
| Teil 2-1.2 Erweiterte Lösungsversuche |
Curcumapulver wird zusammen mit verdünnter Natronlauge oder mit demin. Wasser unter Zugabe von Natriumhydroxid-Plätzchen aufgeschlämmt.
Beobachtungen:
Die alkalische Extraktion liefert eine tiefrote Lösung.
Auswertung:
Im Alkalischen löst sich der Farbstoff Curcumin besser als im Neutralen.
Ergebnis:
Will man eine hochkonzentrierte Curcumin-Lösung erhalten, empfiehlt sich eine Extraktion im alkalischen Milieu.

Abb. 76
(Bilder Mara Heyer / Katrin Wittwer)
Aufgeschlämmtes Curcuma in Natronlauge (links) und Wasser (rechts)
| Teil 2-2: Umschlag von Curcumaextrakt | zum Seitenanfang  |
Der wässrige gekochte Auszug sowie der ethanolische Auszug werden mit Hilfe von 0,1 M Natronlauge und 0,1 M Salzsäure auf Farbreaktion im Alkalischen und Sauren getestet.
Beobachtung:
Im stark Sauren und Neutralen sind die Lösungen gelb und im stark Alkalischen orange gefärbt.
Beim ethanolischen Auszug ist der Umschlag deutlicher erkennbar, außerdem können diese Lösungen stark verdünnt werden und behalten dennoch eine hohe Farbintensität.
Beim ethanolischen Auszug konnte der Umschlag bereits nach zwei Tropfen ~ 0,1 M Natronlauge beobachtet werden.
 |
Abb. 77 (Bilder Mara Heyer / Katrin Wittwer) Umschlag des gekochten wässrigen Auszugs: sauer (links), neutral (Mitte) und alkalisch (rechts) |
 |
Abb. 78 (Bilder Mara Heyer / Katrin Wittwer) Umschlag des ungekochten wässrigen Auszugs: neutral (links) und alkalisch (rechts) |
 |
Abb. 79 (Bilder Mara Heyer / Katrin Wittwer) Umschlag ethanolischen Auszugs: neutral (links) und alkalisch (rechts) |
Auswertung:
Der für die Färbung von Curcuma hauptsächlich verantwortliche Farbstoff Curcumin absorbiert im Alkalischen eine andere Wellenlänge des sichtbaren Lichtes als im Sauren oder Neutralen. Curcumaextrakt fungiert demnach als Säure-Base-Indikator und kann dazu verwendet werden, um Säuren von Basen zu unterscheiden.
| Teil 2-3: Versuch der Definition des genauen Umschlagsbereiches von Curcumaextrakt | zum Seitenanfang  |
Der pH-Wert eines wässrigen Curcumaextraktes wird unter Zuhilfenahme einer pH-Elektrode gemessen. Dann wird so lange ~ 0,1 M Natronlauge zugetropft bis der Umschlag erkennbar ist und erneut gemessen. Nach Alkalisierung der Lösung wird unter Zugabe von ~ 0,1 M Salzsäure erneut der Umschlag aufgesucht und der zugehörige pH-Wert gemessen.
Messwerte:
| Eigen-pH-Wert des Curcumaextraktes: | 6,65 |
| Umschlag vom Sauren ins Alkalische: | bei pH 8,17 |
| Umschlag vom Alkalischen ins Saure: | bei pH 7,63 |
Auswertung und Ergebnis:
Der Umschlag des Curcumaextraktes wurde auf den pH-Bereich 7,50 - 8,50 eingegrenzt.
| Teil 2-4: Untersuchung zur Haltbarkeit das Curcumaextraktes | zum Seitenanfang  |
Analog zu den Überlegungen über die Ermittlung der Haltbarkeit des Rotkohlsaftes bezüglich seines Farbstoffes kann man auch beim Curcumaextrakt vorgehen.
So ließe sich zum Beispiel die maximale Wellenlänge des wässrigen Curcumaauszuges durch Abfahren eines Absorptionsspektrums ermitteln und die Extinktion bei dieser Wellenlänge in einem gewissen Zeitraum beobachten. Voraussetzung wäre dabei jedoch dass der pH-Wert sich in diesem Zeitraum nicht verändert und sich damit das Maximum der Wellenlänge nicht verschiebt.
Oder es wird versucht mit Hilfe neutraler, saurer und basischer Curcuma-Lösungen einen isosbestischen Punkt zu finden, um dann bei dieser pH-unabhängigen Wellenlänge die Extinktion des wässrigen Auszugs zu verfolgen.
Messwerte:
Wässriger Auszug von Curcuma
pH-Wert = 5 - 6
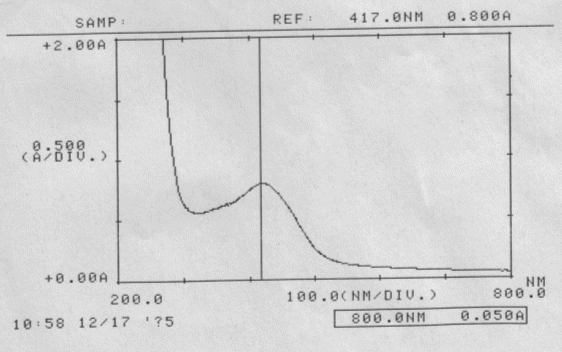
Abb. 80
Curcuma wässriger Auszug; gemessen am 17.12.05
Absorptionsspektrum
Auswertung:
Wellenlänge des Absorptionsmaximums:
λmax = 417 nm
Eine Haltbarkeitsreihe bei dieser Wellenlänge wurde jedoch nicht durchgeführt. Stattdessen wurde ein eventueller isosbestischer Punkt aufgesucht.
Messwerte:
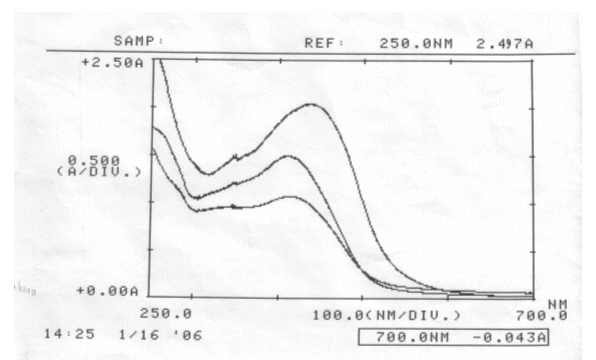
Abb. 81
Curcuma sauer, basisch, neutral; gemessen am 16.01.06
Absorptionsspektrum
Auswertung:
| λmax(alkalische Curcumalösung) | ~ 428 nm |
| λmax(neutrale Curcumalösung) | ~ 412 nm |
| λmax(saure Curcumalösung) | ~ 409 nm → Lösung war leicht trüb |
Es ist kein isosbestischer Punkt ermittelbar, da die drei Kurven sich nicht gemeinsam in einem Punkt schneiden.
Deswegen wurde keine Haltbarkeitsreihe durchgeführt.
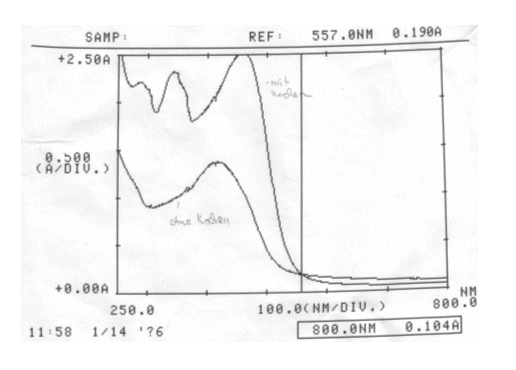
Messwerte:
 |
 |
| Abb. 82 Curcuma mit Kochen basisch; ohne Kochen sauer gemessen am 14.01.06 Absorptionsspektrum |
Abb. 83 zu verdünnter Curcumaextrakt gemessen am 16.01.06 Absorptionsspektrum |
Auswertung:
Zur Abbildung 82:
Missglückter Versuch zur Haltbarkeitsreihe. Eigentlich sollte entweder nur der gekochte Auszug basisch und sauer, oder aber nur der ungekochte Auszug basisch und sauer gemessen werden. Es hätte in einem weiteren Versuch getestet werden müssen, ob gekochter und ungekochter Auszug im Vergleich unterschiedliche Absorptionsmaximas ergeben, ob sich der Farbstoff also durchs Kochen verändert.
Zur Abbildung 83:
Hier war der Extrakt zu stark verdünnt, so dass sich kein Absorptionsmaximum ergab.
Ergebnis:
Die Versuche die Haltbarkeit von Curcumin zu verfolgen sind nicht erfolgreich gewesen, da kein isosbestischer Punkt gefunden werden konnte und nicht genügend Zeit vorhanden war dem Problem nachzugehen.
| Teil 2-5: Überprüfung der Eignung von Curcumaextrakt zur Endpunktsindikation einer Neutralisationstitration | zum Seitenanfang  |
Ermittlung des Endpunktes unter Variation verschiedener Faktoren.
| Teil 2-5.1 Titration von starker Säure mit starker Base mit wässrigem Curcuma-Auszug als Indikator |
| Vorlage: | 10,00 ml ~ 0,1 M Salzsäure t = 1,1148 |
| Maßlösung: | ~ 0,1 M Natronlauge t = 1,1665 |
| theoretischer Endpunkt: | cNaOH • VNaOH • tNaOH = cHCl • VHCl • tHCl |
| daraus folgt: | VNaOH = (cHCl • VHCl • tHCl) / (cNaOH • tNaOH) VNaOH = 9,56 ml |
| Titrationsgeschwindigkeit: | normal schnell gleich nach Indikatorzugabe titriert |
| Indikator: | |
| Menge an Indikator: | 2,0 ml wässriger Curcuma-Auszug (501,2 mg Curcuma aufgeschlämmt in 100 ml demin. Wasser) |
| Verdünnung mit demin. Wasser: | ~ auf 100 ml aufgefüllt |
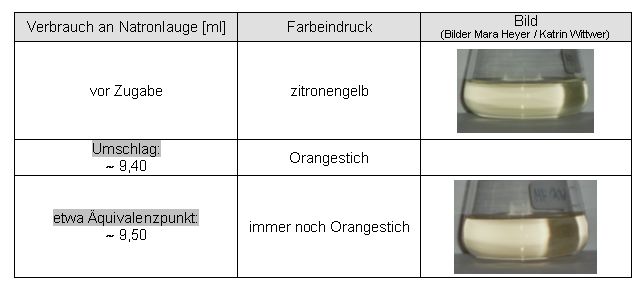
Auswertung:
Der wässrige ungekochte Auszug eignet sich nicht sonderlich gut für die Indikation einer Säure-Base-Titration, da durch die hohe Verdünnung die Farbe und somit der Umschlag relativ schlecht sichtbar sind.
Die Abweichung des praktisch ermittelten Endpunktes (9,40 ml Maßlösung) vom theoretischen Endpunkt (9,56 ml Maßlösung) beträgt 0,16 ml.
9,56 ml = 100 %
0,16 ml = 1,7 %
Ergebnis:
Der erste Versuch einer Titration von Salzsäure mit Natronlauge mit wässrigem Curcumaextrakt als Indikator führte zu dem Ergebnis, dass der praktisch ermittelte Endpunkt vom berechneten Wert um mindestens 2% abweicht.
| Teil 2-5.2 Titration von schwacher Säure mit starker Base mit alkalischem Curcuma-Auszug als Indikator |
| Vorlage: | 10,00 ml ~ 0,1 M Essigsäure t = 1,7142 |
| Maßlösung: | ~ 0,1 M Natronlauge t = 1,1725 |
| theoretischer Endpunkt: | cNaOH • VNaOH • tNaOH = cHAc • VHAc • tHAc |
| daraus folgt: | VNaOH = (cHAc • VHAc • tHAc) / (cNaOH • tNaOH) VNaOH = 14,62 ml |
| Titrationsgeschwindigkeit: | normal schnell gleich nach Indikatorzugabe titriert |
| Indikator: | ~ 250 mg mit demin. Wasser auf ca. 50 ml aufgefüllt + 2 NaOH-Plätzchen und mit ~ 0,1 M Salzsäure versetzt bis gerade Umschlag nach gelb |
| Menge an Indikator: | a) 5 Tropfen Curcuma-Auszug b) 20 Tropfen Curcuma-Auszug |
| Verdünnung mit demin. Wasser: | ~ auf 100 ml aufgefüllt |
kein Ergebnis, da nach einer Bürettenfüllung kein Umschlag erkannt werden konnte
Umschlag nach 14,75 ml
Auswertung:
Die Menge an verwendetem Indikator war zu gering, so dass der Endpunkt mit bloßem Auge nicht zu erkennen war.
Die Abweichung des praktisch ermittelten Endpunktes (14,75 ml Maßlösung) vom theoretischen Endpunkt (14,62 ml Maßlösung) beträgt 0,13 ml.
14,62 ml = 100 %
0,13 ml = 0,9 %
Ergebnis:
Dieser Versuch zeigt, dass auch alkalisch gewonnener, anneutralisierter Curcumaextrakt zum Titrieren verwendet werden kann. In diesem vorliegendem Fall (Titration mit einer schwachen Säure) betrug die Abweichung zum theoretisch berechneten Endpunkt gerade mal 1%.
Ob es sich dabei um reinen Zufall handelt, müsste mit wiederholten Versuchen geprüft werden.
| Teil 2-5.3 Vergleich der Eignung von Curcuma-Indikator bei der Titration verschieden starker Säuren - wo ist der Indikator besser anwendbar |
Ziel dieser Versuchsreihe war es die Brauchbarkeit von Curcuma als Indikator einer Neutralisationstitration zu testen.
Dabei wurde zwischen ethanolischen und wässrigem Curcumaauszug, der zu titrierenden Säure, der Testpersonen und der Menge an Indikator variiert.
Teil 2-5.3.1 Versuchsreihe Salzsäure
| Vorlage: | 10,00 ml ~ 0,1 M Salzsäure t = 1,1603 |
| Maßlösung: | ~ 0,1 M Natronlauge t = 0,9722 |
| theoretischer Endpunkt: | cNaOH • VNaOH • tNaOH = cHCl • VHCl • tHCl |
| daraus folgt: | VNaOH = (cHCl • VHCl • tHCl) / (cNaOH • tNaOH) VNaOH = 11,93 ml |
| Titrationsgeschwindigkeit: | normal schnell gleich nach Indikatorzugabe titriert |
| Indikator: | ethanolischer Auszug aus 0,54 g Curcuma und 25 ml Ethanol wässriger gekochter Auszug aus 0,51 g Curcuma und 25 ml Wasser |
| Menge an Indikator: |
|
| Verdünnung mit demin. Wasser: | ~ auf 100 ml aufgefüllt |
Messwerte:
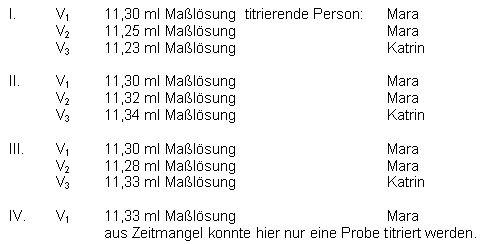
Auswertung:
Da sich der Verbrauch an Maßlösung zwischen den Testpersonen nicht signifikant unterscheidet werden die drei Werte zum jeweiligen Versuch gemittelt.

Die den unterschiedlichen Indikatormengen entsprechenden Titrationswerte hätten im Prinzip schon vor Ermittlung der Abweichung vom Äquivalenzpunkt gemittelt werden können, da die Unterschiede der einzelnen Werte im Bereich eines zufälligen Fehlers liegen.
Ergebnis:
Bei der Titration mit dem ethanolischen Indikator beträgt die Abweichung des ermittelten Endpunktes vom Äquivalenzpunkt um die 5%. Dabei liegt der Verbrauch an Maßlösung unter dem theoretisch berechneten Verbrauch.
Die Tropfenanzahl an Indikator scheint das Ergebnis nicht nennenswert zu beeinflussen (bei 5 - 15 Tropfen). Zur besseren Visualisierung können also getrost 15 Tropfen Indikator verwendet werden.
Mit dem wässrigen Indikator konnte scheinbar ein gleichwertiges Ergebnis erzielt werden. Jedoch ist eine Probe nicht repräsentativ genug um diese eindeutig zu belegen.
Teil 2-5.3.2 Versuchsreihe Essigsäure
| Vorlage: | 10,00 ml ~ 0,1 M Essigsäure t = 1,7101 |
| Maßlösung: | ~ 0,1 M Natronlauge t = 0,9722 |
| theoretischer Endpunkt: | cNaOH • VNaOH • tNaOH = cHCl • VHAc • tHAc |
| daraus folgt: | VNaOH = (cHAc • VHAc • tHAc) / (cNaOH • tNaOH) VNaOH = 17,59 ml |
| Titrationsgeschwindigkeit: | normal schnell gleich nach Indikatorzugabe titriert |
| Indikator: | ethanolischer Auszug aus 0,54 g Curcuma und 25 ml Ethanol wässriger gekochter Auszug aus 0,51 g Curcuma und 25 ml Wasser |
| Menge an Indikator: |
|
| Verdünnung mit demin. Wasser: | ~ auf 100 ml aufgefüllt |
Messwerte:

Auswertung:
Da sich der Verbrauch an Maßlösung zwischen den Testpersonen signifikant unterscheidet können nicht alle drei Werte zum jeweiligen Versuch gemittelt werden.

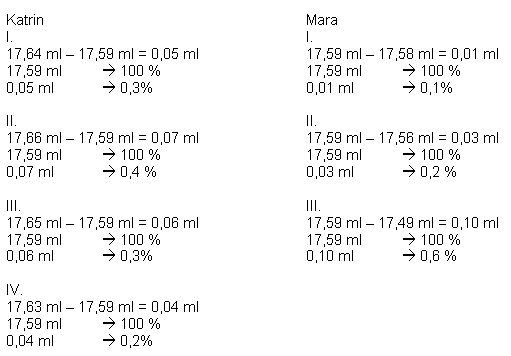
Die den unterschiedlichen Indikatormengen entsprechenden Titrationswerte hätten im Prinzip schon vor Ermittlung der Abweichung vom Äquivalenzpunkt gemittelt werden können, da die Unterschiede der einzelnen Werte im Bereich eines zufälligen Fehlers liegen.
Ergebnis:
Bei der Titration mit dem ethanolischen Indikator beträgt die Abweichung des ermittelten Endpunktes vom Äquivalenzpunkt unter 1%. Dabei hat Testperson Nr. 1 (Katrin) unabhängig von der zugegebenen Menge an Indikator jeweils mehr Maßlösung verbraucht als berechnet. Testperson Nr. 2 (Mara) hat unabhängig von der zugegebenen Menge an Indikator jeweils weniger Maßlösung verbraucht als berechnet. Es besteht also offensichtlich wiederum keine signifikante Abhängigkeit von der Menge an zugegebenen Indikator (bei 5 - 15 Tropfen). Wie groß die Abhängigkeit des Endpunktes von der titrierenden Person ist, bedarf weiterer Untersuchung.
Mit dem wässrigen Indikator konnte scheinbar ein gleichwertiges Ergebnis erzielt werden. Jedoch ist eine Probe nicht repräsentativ genug um dies eindeutig zu belegen.
| Teil 2-5.4 Probanden-Test |
Um die Abhängigkeit des praktischen Endpunktes vom Auge des Betrachters näher zu untersuchen, wurden zwei Testpersonen ausgewählt, die zuvor noch keine Titration mit Curcuma durchgeführt hatten.
Als Analysenlösung wurde die Essigsäure gewählt, da diese im Vorversuch (5.3) einen geringeren Indikatorfehler ergab als die Salzsäure.
Als Indikator wurde der ethanolische Curcumaextrakt gewählt, da dieser im Vorversuch zufrieden stellende Ergebnisse lieferte und zudem genügend an Extrakt vorhanden war. Außerdem ist seine Herstellung weniger aufwändig als die des wässrigen Auszugs.
Messwerte:
- Proband: Sarah Imber
- Proband: Stefan Bosch
Aufgabenstellung: Quantitative Analyse einer Essigsäurelösung mit Hilfe von ethanolischem Curcumaextrakt als Indikator.
| Vorlage: | 10,00 ml ~ 0,1 M Essigsäure t = 1,7101 |
| Maßlösung: | ~ 0,1 M Natronlauge t = 0,9722 |
| theoretischer Endpunkt: | cNaOH • VNaOH • tNaOH = cHCl • VHAc • tHAc |
| daraus folgt: | VNaOH = (cHAc • VHAc • tHAc) / (cNaOH • tNaOH) VNaOH = 17,59 ml |
| Indikator: | ethanolischer Auszug aus 0,54 g Curcuma und 25 ml Ethanol |
| Menge an Indikator: | 10 - 15 Tropfen |
| Verdünnung mit demin. Wasser: | ~ auf 100 ml aufgefüllt |

Ergebnis:
Bei beiden Probanden liegt der Indikatorfehler unter 1%.
Curcumaindikator (ethanolischer Auszug) scheint sich also sehr gut für die Titration von Essigsäure zu eignen.
| Teil 2-6: Herstellung von Indikatorpapier | zum Seitenanfang  |
 Abb. 86 (Bilder Mara Heyer / Katrin Wittwer) |
Einzelne Filterpapierstreifen werden in einen recht konzentrierten Curcumaextrakt getaucht, getrocknet (an Luft oder im Trockenschrank bei bis zu 80°C) und der Vorgang so oft wiederholt bis die gewünschte Farbintensität vorliegt. Das Indikatorpapier zeigt nun wie der Curcumaextrakt selbst beim Eintauchen in alkalische Lösungen basische Wirkung an. |
| Teil 2-7: Borat-Nachweis mit Curcuma-Papier | zum Seitenanfang  |
| Teil 2-7.1 Erste Durchführung auf der Grundlage einer unvollständigen Versuchsanordnung |
Gegebene Information:
Borat färbt in Anwesenheit von Oxalsäure Curcuma-Papier im Alkalischen grün.
| 1. Versuch |
Beobachtung: Begründung: |
| 2. Versuch |
siehe 1. Versuch nur unter Zusatz von mehr Natronlauge Beobachtung: Deutung: |
| 3. Versuch |
siehe 2. Versuch, nur mit mehr Borax-Lösung Beobachtung: Deutung: |
| 4. Versuch |
Borax-Lösung lediglich mit Natronlauge versetzt und Curcuma-Papier eingetaucht. Beobachtung: Deutung: |
| 5. Versuch |
Borax direkt in Salzsäure gelöst und mit Natronlauge alkalisiert. Beobachtung: Deutung: |
| Teil 2-7.2 Zweite Durchführung auf der Grundlage intensiverer Nachforschung |
Die auf Borat zu untersuchende Lösung wird mit ~ 0,1 M Salzsäure auf pH 1-2 gebracht und das Curcuma-Papier in die Lösung getaucht. Nach dem Trocknen färbt sich das Papier in Anwesenheit von Borat je nach Konzentration orange bis rot. Dann wird die Reaktionszone in konzentrierte Natronlauge getaucht. In Anwesenheit von Borat färbt sich diese grün bis schwarz. Beim Fehlen von Borat färbt sich das Papier aufgrund der Lauge braunrot.
| Versuch: |
Beobachtung: |
| Versuch: |
Beobachtung: Ergebnis: |
| Teil 2-8: Untersuchung der Komplexbildung von Curcumin mit Eisen- und Aluminiumionen | zum Seitenanfang  |
2 ml Curcumaextrakt werden mit dem entsprechenden Metallsalz (ein bis zwei Spatelspitzen) versetzt, mit demin. Wasser versetzt und so lange geschüttelt bis das Salz gelöst ist. Dann wird die Lösung geteilt und die eine mit verdünnter Salzsäure (~ 0,1 M) angesäuert und die andere mit verdünnter Natronlauge (~ 0,1 M) alkalisiert.
Verwendete Salze:
FeCl3 • 6 H2O
AlK(SO4)2 • 12 H2O
Eisen(III)-Salz:
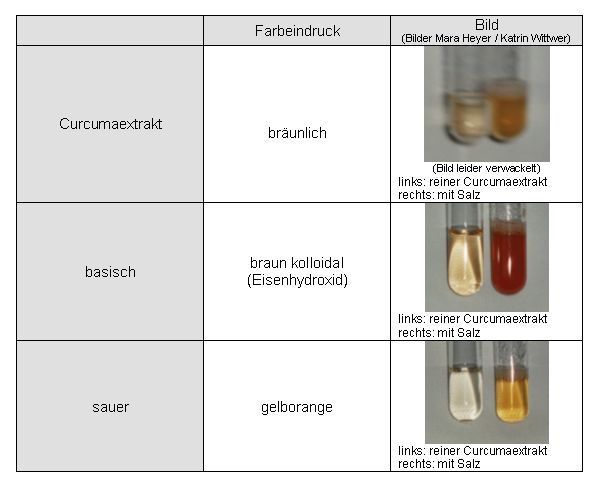
Al(III)-Salz:
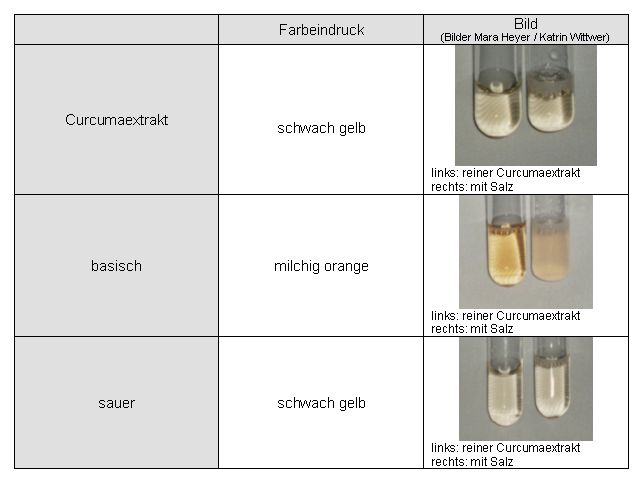
Auswertung:
Es konnten keine intensiven Färbungen festgestellt werden. Die braunen bis gelblichen Lösungen beim Zusatz von Eisen(III)-Salz sind auf die Bildung von Eisenhydroxid zurückzuführen. Die milchige Trübung beim Aluminium(III)-Salz-Zusatz im Alkalischen beruht auf der Bildung von Aluminiumhydroxid.
Ergebnis:
Curcumin scheint mit Eisen(III)- und Aluminium(III)-Salzen keine Komplexe zu bilden.
| Teil 2-9: Redoxreaktionen von Curcumin | zum Seitenanfang  |
2 ml wässrige Curcumalösung werden mit Reduktions- bzw. Oxidationsmittel versetzt und die Farbreaktionen beobachtet.
Messwerte:
Zugabe von 3 Spatelspitzen Dithionit
Gasentwicklung
feuchtes pH-Papier im Gasraum zeigt keine FarbreaktionZugabe von 2 1/2 Pasteurpipetten 33 %igem Wasserstoffperoxid nach langem Schütteln und warten keine Reaktion erkennbar.
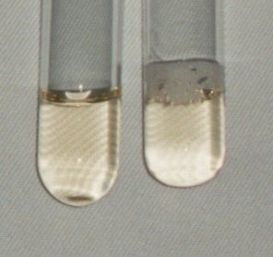 |
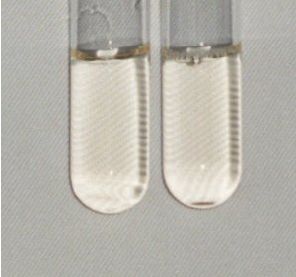 |
| Abb. 93 Zu 1. links: reiner Curcumaextrakt rechts: mit Salz |
Abb. 94 Zu 2. links: reiner Curcumaextrakt rechts: mit Salz |
Auswertung:
Dithionit ist ein Reduktionsmittel. Da keine Farbreaktion stattfindet scheint Curcumin unter diesen Bedingungen nicht reduzierbar zu sein.
Wasserstoffperoxid müsste im Curcumamilieu (leicht sauer) oxidierend wirken. Da keine Farbreaktion stattfindet scheint Curcumin unter diesen Bedingungen nicht oxidierbar zu sein.
Ergebnis:
Curcumin geht unter diesen Bedingungen keine Redoxreaktionen ein.
| 3. Literaturverzeichnis | zum Seitenanfang  |
- D. Harris: Lehrbuch der quantitativen Analyse, Springer-Verlag, Berlin/Heidelberg 2002
- Jander Jahr: Maßanalyse, 15. Auflage, Walter de Gruyter, Berlin/New York 1989
- Georg Schwedt: Chemische Experimente in naturwissenschaftlich-technischen Museen, Wiley-VCH, Weinheim 2003
- Georg Schwedt: Chemische Experimente in Schlössern, Klöstern und Museen, Wiley-VCH, Weinheim 2002
- Georg Schwedt: Goethes chemische Experimente, Aulis-Verl. Deubner, Köln 1999
- Georg Schwedt: Farbstoffen analytisch auf der Spur, Aulis-Verl. Deubner, Köln 1996
- Georg Schwedt: Taschenatlas der Lebensmittelchemie, Thieme, Stuttgart 1999
- H. Schweppe: Handbuch der Naturfarbstoffe. ecomed, Landsberg/Lech 1993
- CD Römpp Chemie-Lexikon, Version1.0, Georg Thieme Verlag, Stuttgart/New York 1995
- www.wikipedia.de (Oktober 2005)
- www.rossleben2001.werner-knoben.de (November 2005)
- www.wzw.tum.de (Dezember 2005)
- www.muenster.org (November 2005)
- www.uni-bayreuth.de (Oktober 2005)
- www.uni-regensburg.de (September 2005)
- www.chemie.fu-berlin.de (Oktober 2005)
- www.uni-bielefeld.de (August 2005)
- www.uni-paderborn.de (Dezember 2005)
| 4. Zusammenfassung | zum Seitenanfang  |
| 4-1. Deutsch | zum Seitenanfang  |
Zusammenfassung
Auf der Suche nach einem Projektarbeitsthema - so lautete unsere erste Aufgabe, bevor es mit der eigentlichen Projektarbeit losging. Von allen Variationen gefiel uns die Thematik der natürlichen Indikatoren, ihrer Wirksamkeit und Anwendung am besten, woraus schließlich unser Thema entstand:
Naturstoffe als Indikatoren
Was Anfangs nur einer wagen Vorstellung entsprach, entwickelte sich im Laufe der Monate mit Fortschreiten der Projektarbeit als umfangreiche Aufgabe und wahre Herausforderung an Kreativität und Einfallsreichtum.
Nahezu selbständig durften wir uns das Thema erarbeiten und selbst entscheiden, wie wir unsere Aufgaben im Labor gestalten würden.
So hat uns das Bearbeiten dieser Projektarbeit schließlich vieles gelehrt:
Das Entwickeln und Umsetzen von eigenen Ideen macht Spaß, dennoch gelangt man durch fehlende Kenntnisse oft an Grenzen.
Das eigenständige Entwickeln und Bearbeiten von Themen bedarf an Übung und erfordert einer besonders guten Vorbereitung inklusive Zeitplanung; Absprache mit dem Arbeitspartner ist nahezu unerlässlich.
Enttäuschungen über nicht funktionierende Versuche bleiben nicht aus, und man erlangt nicht immer zufrieden stellende Ergebnisse.
Motiviert man sich dennoch wieder und probiert neue Wege, dann gelangt man zu viel praktischer Erfahrung und oft schließlich doch zu Erfolgen.
Das Thema Naturstoffe als Indikatoren eröffnet ein weites Feld: es existieren zahlreiche natürlich vorkommende Stoffe, welche in Form einer Farbreaktion das Erreichen bestimmter Zustände, wie zum Beispiel eine pH-Wert-Änderung, anzeigen können.
Stellvertretend für die große Farbstoffgruppe der Anthocyane und als klassisches Beispiel für einen Naturstoff als Indikator begannen wir unsere praktischen Arbeiten mit dem Rotkohl.
Als Aufgabenstellung setzten wir uns das Ziel, seine Indikatoreigenschaften und seine Handhabung zu untersuchen und schließlich seine Einsetzbarkeit als Indikator für die Maßanalyse zu testen.
Unsere praktischen Arbeiten führten uns dabei über das Austesten verschiedener Extraktionsverfahren, das Überprüfen des Reaktionsverhaltens des Saftes vor allem auf pH-Wert-Änderungen, über das Austesten der Eignung des Saftes als Säure-Base-Indikator bei Neutralisationstitrationen hin zur Untersuchung der Haltbarkeit unseres "Indikators“.
Bei einem Naturstoff sollte es jedoch nicht bleiben, und so überprüften wir gleichermaßen das Verhalten eines Curcuma-Extraktes.
In den Ergebnissen unserer praktischen Arbeiten schnitt der Rotkohlsaft bei der Durchführbarkeit einer Neutralisationstitration als nicht sehr geeignet ab, als Indikator zur Ermittlung des pH-Werts einer Lösung jedoch lässt er sich dank seiner universellen Farbreaktionen hervorragend einsetzen.
Curcuma-Extrakt, eingesetzt als pH-Indikator, lieferte bei der Titration von Essigsäure mit Natronlauge recht gute Ergebnisse.
Beim Dokumentieren der kompletten Arbeit schließlich kamen uns noch zahlreiche Ideen, was noch hätte ausprobiert und untersucht werden können, leider blieb uns dafür schließlich keine Zeit mehr.
In diesem Rahmen möchten wir uns herzlich bei all denen bedanken, die uns mit Rat und Tat zur Seite standen (danke Frau Pfiz!) und uns durch ihre Unterstützung die Arbeit erleichtert haben (danke an alle Assistenten und an Sarah Imber und Stefan Bosch).
| 4-2. Englisch | zum Seitenanfang  |
Summary
Searching for a theme that was our first exercise before starting with the project itself.
Out of all varieties the theme "natural substances as indicators" we liked best and so our task was born.
Within our project we had the possibility to work out a theme for ourselves and to decide what to do in the laboratory. And therefore we learned a lot about the conditions of developing a practical task and working it out in form of experiments.
Concerning our theme, there are various examples for natural substances that indicate the reaching of special states in form of colour reactions.
On behalf of the big group of anthocyanes and as a classical example for natural indicators we started our work with red cabbage.
We made it to our business to examine its indicator characteristics and handling as well as to find out its qualification for indicating a titration. Our work in the laboratory included testing several extractions for gaining red cabbage juice, checking its chemical reactions, testing its qualification to indicate the ending point of a neutralization titration and examining its keeping quality.
However it shouldn't end with only one indicator, so we tested the extract of curcuma the same way like red cabbage juice.
The results of our practical work show that red cabbage juice isn't really qualified for indicating the ending point of a neutralization titration, but it can be used for testing a solution whether it reacts base or acid.
Curcuma instead gives some recognizable results in indicating the ending point of the titration of acetic acid with lye.
While documenting the whole project we got several new ideas what could also have been done in the laboratory, but there wasn't enough time to realize them.
« zurück zur Übersicht - Projektarbeiten





