« zurück zur Übersicht - Projektarbeiten
"Tinte aus Naturstoffen"
von Oliver Odenbach und Müjdat Ay, CTA-Lehrgang 66 (Schuljahr 2016/17)
| 1 | Vorwort |
| 2 | Zusammenfassung |
| 3 | Summary |
| 4 | Einleitung |
| 5 | Theoretischer Teil |
| 5-1 | Definition "Tinte" |
| 5-2 | Geschichte der Tinte |
| 6 | Praktischer Teil |
| 6-1 | Tinte aus schwarzem Tee |
| 6-2 | Tinte aus Eichenrinde |
| 6-3 | Tinte aus Bananenschalen |
| 6-4 | Tinte aus Rotkohl |
| 6-5 | Tinte aus Rotwein |
| 6-6 | Tinten aus Tannin |
| 6-7 | Berliner Blau |
| 6-8 | Eisengallustinte |
| 7 | Geheimtinten |
| 7-1 | Zitronensaft |
| 7-2 | Knoblauchsaft und Alaun |
| 7-3 | Stärke-Lösung |
| 7-4 | Eisen(III)chlorid-Lösung |
| 7-5 | Kupfersulfat-Lösung |
| 7-6 | Powerade (Wild Cherry) |
| 7-7 | Saubär-Badewasserfarbe |
| 8 | "Zaubertinte" |
| 9 | Tusche |
| 9-1 | Kerzenruß |
| 9-2 | Asche aus Zucker |
| 10 | Bedeutung und genereller Aufbau der Tinte |
| 11 | Literaturverzeichnis |
1. Vorwort
Vorweg möchte ich mich bei Frau Pfiz für die Auswahl dieses tollen Themas bedanken. Im Laufe der Ausarbeitung und der praktischen Auseinandersetzung rund um das Themengebiet "Tinten aus Naturstoffen" wurde mein persönliches Interesse am Thema immer mehr geweckt und die Faszination, welch tolle Effekte mit simplem chemischen Wissen erzielt werden können, stieg mit jedem weiteren praktischen Versuch an. Des Weiteren möchte ich mich insbesondere bei Herrn Dittus bedanken, der mir bei der praktischen Ausarbeitung des Themas immer wieder Tipps gab, selber Interesse am Thema zeigte und auf eigene Initiative hin Versuche zum Thema durchführte, dessen Ergebnisse er mit mir teilte. Auch bei Frau Hornstein möchte ich mich bedanken, da sie ebenfalls Interesse am Thema zeigte, wobei sie vor allem beim Testen der Tinten und deren Effekte mitwirkte und Hinweise auf eine eventuelle Verbesserung des optischen Effekts gab. Mein Dank gilt ebenfalls Sophie Deschler, da sie sich stets bereit erklärte, die Dokumentation während ihrer Entstehung durchzulesen, mich dabei auf Fehler grammatikalischer und orthographischer Art hinzuweisen und diese zu verbessern. Zuletzt möchte ich mich bei Herrn Zinsmeister bedanken, der mir Rezepte als Anregung für weitere praktische Versuche, ohne Bitte meinerseits, ausdruckte.
2. Zusammenfassung
Das Ziel dieser Arbeit ist es, dem Leser einen möglichst guten Überblick darüber zu verschaffen, wie vielseitig das Thema "Tinte aus Naturstoffen" ist und ihm ein generelles Verständnis darüber zu vermitteln, was eine Tinte ausmacht. Dies geschieht vor allem durch die praktische Ausarbeitung der verschiedensten Tinten aus unterschiedlichen Ausgangsstoffen und unterschiedlichen Zusatzstoffen mit unterschiedlicher Funktion. So wurden Tinten aus Naturstoffen wie Bananen und Rotkohl gefertigt, aber auch sogenannte Geheimtinten, z.B. aus einer Stärke-Lösung, hergestellt, die selbst Verwendung bei der CIA fanden. Die generelle Idee ist es, ein möglichst breites Spektrum abzudecken, um den Begriff der Tinte in seiner Art zu erörtern und die Funktionsweise dieser mit praktisch anschaulichem Material zu erklären.
3. Summary
The aim of this project report is to give the reader the best possible overview of how versatile the subject "ink from natural materials" is by giving him the general understanding of what accounts an ink. This is mainly achieved by the practical elaboration of a wide variety of inks made out of different starting materials and different additives with different functions. Thus, inks were made from natural substances such as bananas and red cabbage, but also so called secret inks out of e.g. a starch solution, which itself found use even at the CIA. The general idea is to cover as wide of a spectrum as possible, in order to explain the general concept of an ink and to explain the functionality with virtually intuitive material.
4. Einleitung
"Die Tinte macht uns wohl gelehrt, doch ärgert sie, wo sie nicht hingehört. Geschrieben Wort ist Perlen gleich, ein Tintenklecks ein böser Streich"
[10] JOHANN WOLFGANG VON GOETHE, LUDWIG TIECK (Hg) (1837), Seite 134
Dieses Zitat von Johann Wolfang von Goethe impliziert, dass die Tinte, damals wie auch heute, eine wichtige Rolle in der Herstellung vieler Dokumente oder sonstiger Schriftwerke spielt. Richtig eingesetzt ist die Tinte ein gutes Mittel seine Gedanken oder Sonstiges auf Papier oder Pergament festzuhalten, falsch aber kann diese auch zu Flecken führen, die so leicht nicht mehr zu entfernen sind. Im Grunde genommen wird hier auf die Eigenschaft der Dokumentenechtheit der Tinte angesprochen. Was genau das bedeutet, welche weiteren Eigenschaften eine Tinte erfüllen muss und aus welchen Stoffen Tinten hergestellt werden können, wird in der folgenden Projektarbeit erörtert.

größere Ansicht
Abb. 1: Sammlung der im Praktikum angefertigten Tinten; erstellt von Oliver Odenbach
5. Theoretischer Teil
5-1. Definition "Tinte"
Der Begriff "Tinte" stammt aus dem Lateinischen und bedeutet "gefärbtes Wasser" (lat.: tincta aqua). Als Tinte gilt eine Flüssigkeit, die in der Lage ist, Papier oder Pergament beim manuellen Auftragen, das heißt durch Schreiben oder Zeichnen mit Hilfe eines Pinsels oder einer Feder, intensiv zu färben. Eine Tinte besteht entweder aus einem homogenen Gemisch von in Wasser gelösten Pigmenten, oder einer Dispersion mindestens zweier Stoffe, die mit einem Bindemittel versetzt werden. Zudem gibt es verschiedene Arten einer Tinte. Im Folgenden werden diese als "normale" Tinte, Geheimtinte und Zaubertinte bezeichnet. Unter einer normalen Tinte versteht man eine Tinte, deren Farbe direkt nach dem Auftragen, ohne weitere menschliche Einwirkung, sichtbar ist. Eine Geheimtinte dagegen verfärbt das Papier nicht direkt nach dem Auftragen, sondern benötigt noch eine spezielle Behandlung, um die Schrift sichtbar zu machen. Der Unterschied zwischen einer Geheimtinte und einer "Zaubertinte" ist der, dass für die Sichtbarmachung der Zaubertinte keinerlei menschliche Einwirkung benötigt wird, sondern nur chemische Prozesse die Färbung, bzw. die Entfärbung bewirken.
5-2. Geschichte der Tinte
Die ersten Tinten wurden bereits 3000 v. Chr. in Ägypten, bzw 2600 v. Chr. in China verwendet. Diese war damals eine simple Rußtinte, indem man Ruß mit Gummiwasser aus Gummi arabicum mischte. Ruß, der zu 80-95 % aus Kohlenstoff besteht und ein schwarzer, pulverförmiger Feststoff ist, erhielt man durch Pyrolyse von Kohlenwasserstoffen. Selbst heutzutage wird industriell hergestellter Ruß als Schwarz-Pigment in Druckfarben verwendet. Gummi arabicum ist das Exsudat (Gummiharz) aus dem Pflanzensaft vieler verschiedener, vor allem in Afrika verbreiteten, Bäumen, wie zum Beispiel dem Gummiarabikumbaum.*
* aus [6] http://www.chemie.de (zuletzt aufgerufen am 29.01.17)

größere Ansicht
Abb.2 : Ruß; aus [1]
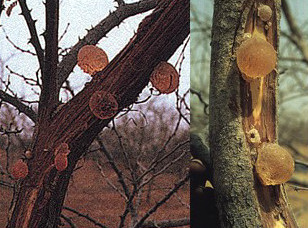
größere Ansicht
Abb.3 : Gummiarabikumbaum aus [2]
Erst etwa 2000 Jahre später wurde diese Art der Tinte durch die Tusche ersetzt. Diese bestand damals aus Nadelholzkohle, Lampenöl und Leim aus Gelatine. Diese Mischung wurde in Stangen gepresst und bei Gebrauch so lange mit Wasser gemischt, bis die Tusche die gewünschte Viskosität erreicht hat. Je höher die Viskosität, desto höher die Deckkraft der Tusche auf Papier.

größere Ansicht
Abb.4 : Set aus Stangentusche; aus [3]
Im 3. Jahrhundert vor Chr. wurde die Eisengallustinte entdeckt. Die Herstellung dieser geschah damals wie heute nach dem gleichen Prinzip. Durch das Abkochen der Galläpfel wurde die Gallussäure gewonnen, welche dann mit Eisensulfat und anschließender Zugabe von Gummi arabicum hergestellt wurde (siehe Kapitel 6.8). Diese Erfindung war besonders bedeutend, da die Eisengallustinte als erste dokumentenechte Tinte gilt, da diese besonders beständig ist und die Farbe über mehrere Jahre hinweg lesbar ist, wobei sie lichtecht (die Farbe verblasst nicht) bleibt und auf Papier nicht ohne Spuren zu hinterlassen entfernbar ist. Die Eisengallustinte prägt diese Zeit bis zum 15. Jahrhundert sehr, da sie quantitativ häufig verwendet wurde.
Im 15. Jahrhundert wurde der Bister erfunden. Dieser wurde damals hergestellt, indem man Glanzruß (Ruß von verbranntem Holz), welches zu Pulver eingedampft wird, mit Wasser verdünnt. Die Farbe variiert je nach verwendeter Holzsorte.

größere Ansicht
Abb. 5: Bister; aus [4]
Heutzutage wird Bister durch Fällung von Mangan(II)chlorid mit Chlorkalk und Kalkhydrat hergestellt.
Eine weitere wichtige Tinte zu dieser Zeit war die Tinte aus Sepia. Sepia ist der grauschwarze Farbstoff, der aus den Tintenbeuteln von Tintenfischen gewonnen wird. Dieser wurde 2-3 Tage an der Sonne getrocknet. Danach wurde die Haut entfernt und der Inhalt in einem Mörser verrieben. Dieses Pulver wird mit Gummiwasser (aus Gummi arabicum) versetzt, wodurch diese Mischung bereits schreibfähig wird.
Da es sich um einen Pigmentfarbstoff handelt, der mit Bindemittel versetzt wurde, entspricht diese Art der Herstellung genaugenommen der einer Tusche. Zur heutigen Zeit wird der Sepienfarbstoff jedoch hauptsächlich zum Färben von Lebensmitteln, wie zum Beispiel von Pasta, benutzt.

größere Ansicht
Abb. 6: Mit Sepiatinte gefärbte Pasta; aus [7]
Die Entwicklung der modernen Chemie im 19. Jahrhundert hatte zur Folge, dass viele Farbstoffe entwickelt wurden, die zum Schreiben eingesetzt wurden. Aufgrund der darauf folgenden starken Verbreitung vieler, zwar schreibfähigen aber nicht dokumentenechten Tinten, mussten alsbald Richtlinien erstellt werden, die festlegen, welche Eigenschaften eine Tinte besitzen muss, damit sie zur Erstellung von permanenten Dokumenten verwendet werden darf. Somit wurde wieder die Eisengallustinte, aufgrund ihrer dokumentenechten Eigenschaften, verwendet und stetig weiter optimiert. Die letzte wichtige Erfindung in der Geschichte der Tinte geht auf die Erfindung des Tintenstrahldruckers zurück. Damit dieser funktionieren kann, muss die verwendete Tinte über eine hohe Mischbarkeit verfügen, um möglichst viele Farbtöne auf diese Weise erzeugen zu können. Zudem muss die Tinte extrem schnell trocknen. Das Druckbild wird dabei durch den gezielten Abschuss, beziehungsweise dem Ablenken kleiner Tintentropfen erzeugt.

größere Ansicht
Abb. 7: Moderner Tintenstrahldrucker; aus [8]
6. Praktischer Teil
6-1. Tinte aus schwarzem Tee
Benötigte Materialien:
Schwarzer Tee (Feinster Darjeeling ganzes Teeblatt von Meßmer), Wasser, Becherglas (600 mL), Siedestab, Keramikplatte, Brenner (Teklu), Dreifuß, Drahtnetz, Eisen(III)chlorid, Gummi arabicum, Tondreieck, Schnelllauftrichter, Filterpapier, Pasteur-Pipette
Versuchsaufbau:
Auf die Keramikplatte wird der Brenner gestellt, darüber der Dreifuß, darauf das Drahtnetz, worauf das Becherglas steht. In dem Becherglas befindet sich der schwarze Tee, Wasser und ein Siedestab. Zum Filtrieren nimmt man einen weiteren Dreifuß, legt ein Tondreieck darauf und steckt den Schnelllauftrichter hinein. In die obere Öffnung des Trichters wird ein zurechtgeschnittenes Filterpapier gelegt und unter den Trichter wird ein Gefäß zum Auffangen der Flüssigkeit bereitgestellt.

größere Ansicht
Abb. 8: Versuchsaufbau zum Versuch Tinte aus Tee; erstellt von Oliver Odenbach
Durchführung:
Eine große Menge Tee wird in das Becherglas gegeben und mit dem doppelten Volumen an Wasser versetzt und zum Kochen gebracht. Dieser sollte nun mindestens 15 Minuten warm gehalten werden, da zum weiteren Vorgehen eine sehr stark konzentrierte Teelösung vorliegen muss. Nach dem Abkühlen wird die Lösung von den festen Teeblättern in ein weiteres Becherglas dekantiert. Diese Lösung wird nun in ein weiteres Gefäß durch ein Filterpapier filtriert (siehe Abb. 9).

größere Ansicht
Abb. 9: Filtration von Tee; erstellt von Oliver Odenbach
Das Filtrat wird mit 10 Tropfen Eisen(III)chlorid Lösung (3 Spatelspitzen festes Eisen(III)chlorid in 10 mL Wasser gelöst) versetzt (siehe Abb. 10) und geschüttelt. Die Lösung verändert ihre Farbe von bräunlich zu schwarz. Versetzt man diese schließlich mit 4-5 Spatelspitzen Gummi arabicum und schüttelt sie nochmal so lange, bis sich alles gelöst hat, erhält man die gewünschte, schreibfähige Tinte (siehe Abb. 11).

größere Ansicht
Abb. 10: Zutropfen der FeCl3-Lösung; erstellt von Oliver Odenbach

größere Ansicht
Abb. 11: Tinte aus Tee auf Papier; erstellt von Oliver Odenbach
Erklärung:
Schwarzer Tee enthält besonders viele Tannine (Gerbstoffe). Es handelt sich hierbei vor allem um Polyphenole (aromatische Systeme mit mehreren Hydroxylgruppen), wie zum Beispiel der Ellagsäure, die sich von der Gallussäure ableiten lassen.
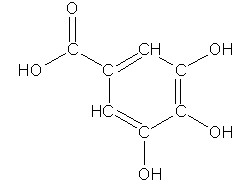
größere Ansicht
Abb. 12: Gallussäure; erstellt von Oliver Odenbach mit "ChemSketch"
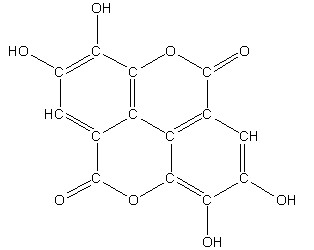
größere Ansicht
Abb. 13: Ellagsäure; erstellt von Oliver Odenbach mit "ChemSketch"
Diese Polyphenole bilden zusammen mit Eisen(III)-Ionen blau-schwarze schwerlösliche Komplexe. Versetzt man diese Lösung mit dem Bindemittel Gummi arabicum erhält man die gewünschte Tinte. Alternativ kann auch grüner Tee verwendet werden, da dieser ebenfalls viele Gerbstoffe enthält.
6-2. Tinte aus Eichenrinde
Benötigte Materialien:
Eichenrinde, Wasser, Becherglas (600 mL), Siedestab, Keramikplatte, Brenner (Teklu), Dreifuß, Eisen(III)chlorid, Gummi arabicum, Schnelllauftrichter, Filterpapier, Tondreieck, Reibschale, Pistill, Pasteur-Pipette
Versuchsaufbau:
Der Versuchsaufbau ist der Gleiche wie bei Tinte aus schwarzem Tee, mit dem Unterschied, dass Eichenrinde in das Becherglas gegeben wird und diese mit dem doppeltem Volumen an Wasser versetzt wird.

größere Ansicht
Abb. 14: Versuchsaufbau "Tinte aus Eichenrinde"; erstellt von Oliver Odenbach
Durchführung:
Die Eichenrinde wird in einer Reibschale mit einem Pistill so lange verrieben, bis sie möglichst fein ist. Danach wird die Rinde in das Becherglas gegeben. Darüber kommt das doppelte Volumen an Wasser (siehe Abb. 14). Die Lösung wird nun mit dem Brenner erhitzt und kurz zum Kochen gebracht. Nach dem Abkühlen wird die Lösung durch ein Filterpapier filtriert und in einem Behälter aufgefangen. Das Filtrat wird nun mit 5-10 Tropfen einer Eisen(III)chlorid-Lösung (3 Spatelspitzen festes Eisen(III)chlorid in 10 mL Wasser gelöst) versetzt. Die ursprünglich braune Lösung färbt sich beim Zutropfen nun schwarz. Diese Lösung wird im Anschluss mit Gummi arabicum versetzt und gut geschüttelt. Wenn die Tinte nicht benutzt wird, sollte sie in einem verschließbaren Gefäß aufbewahrt werden.
Erklärung:
Eichenrinde enthält wie auch der schwarze Tee besonders viele Tannine. So bilden auch diese Tannine durch Zugabe von Eisen(III)-Ionen einen schwarz-blauen schwerlöslichen Komplex, der unter Zugabe von Gummi arabicum die gewünschte Tinte ergibt (siehe Abb. 15).

größere Ansicht
Abb. 15: Tinte aus Eichenrinde auf Papier; erstellt von Oliver Odenbach
6-3. Tinte aus Bananenschalen
Benötigte Materialien:
Bananenschalen zweier Bananen, Becherglas (600 mL), Siedestab, Keramikplatte, Brenner (Teklu), Dreifuß, Eisen(III)chlorid, Gummi arabicum, Schnelllauftrichter, Filterpapier, Tondreieck, Messer, Pasteur-Pipette
Versuchsaufbau:
Der Versuchsaufbau ist der gleiche wie zuvor bei 6.1 Tinte aus schwarzem Tee, mit dem Unterschied, dass die Bananenschalen zweier Bananen in das Becherglas gegeben und knapp mit Wasser bedeckt werden.

größere Ansicht
Abb. 16: Versuchsaufbau zum Versuch "Tinte aus Bananenschalen"; erstellt von Oliver Odenbach
Durchführung:
Die Schalen zweier Bananen werden in kleine Würfel geschnitten und anschließend in das Becherglas gegeben. Nun wird so viel Wasser dazugegeben, bis die Schalen knapp bedeckt sind. Dieses Gemisch wird nun erhitzt und kurz zum Kochen gebracht, damit sich die Gerbstoffe aus den Bananenschalen extrahieren lassen. Anschließend wird die Lösung weitere 15-20 Minuten warm gehalten, dabei färbt sich die Lösung zunehmend bräunlich. Nach dem Abkühlen wird die Lösung von den Bananenschalen in ein anderes Gefäß abdekantiert. Diese Lösung wird nun in ein weiteres Gefäß durch ein Filterpapier filtriert. Das Filtrat wird mit 5-10 Tropfen Eisen(III)chlorid-Lösung (3 Spatelspitzen festes Eisen(III)chlorid in 10 mL Wasser gelöst) versetzt (siehe Abb. 17) und gut geschüttelt. Die Lösung verändert dabei ihre Farbe von bräunlich zu schwarz. Nach Zugabe von 4-5 Spatelspitzen Gummi arabicum erhält man nach gutem Schütteln die gewünschte Tinte (siehe Abb. 18).

größere Ansicht
Abb. 17: Zugabe der FeCl3-Lösung; erstellt von Oliver Odenbach

größere Ansicht
Abb. 18: Tinte aus Bananenschalen auf Papier; erstellt von Oliver Odenbach
Erklärung:
Bananenschalen enthalten wie Eichenrinde und Tee Gerbstoffe, jedoch in einer niedrigeren Konzentration, weshalb man die Lösung konzentrierter ansetzen muss. Versetzt man dann diese gerbstoffhaltige Lösung mit Eisen(III)-Ionen bildet sich der schwarz-blaue schwerlösliche Komplex, der durch Zugabe von Gummi arabicum die gewünschte Tinte ergibt.
6-4. Tinte aus Rotkohl
Benötigte Materialien:
Rotkohl, Becherglas (600 mL), Siedestab, Keramikplatte, Brenner (Teklu), Dreifuß, Eisen(III)chlorid, Gummi arabicum, Schnelllauftrichter, Filterpapier, Tondreieck, Messer, Pasteur-Pipette
Versuchsaufbau:
Der Aufbau entspricht dem von 6.1 Tinte aus schwarzem Tee mit dem Unterschied, dass der Rotkohl in das Becherglas gegeben wird.
Durchführung:
Etwa 2 Blätter des Rotkohls werden mit dem Messer in feine Würfel geschnitten und zusammen mit 250 mL Wasser in ein Becherglas gegeben. Dieses Gemisch wird 25-30 Minuten in der Wärme bei etwa 70°C mehrmals gerührt. Nach dem Abkühlen wird die Lösung vom Rotkohl durch Dekantieren in ein weiteres Becherglas getrennt. Diese Lösung wird nun durch ein Filterpapier in ein weiteres Gefäß filtriert. Das Filtrat wird mit 5- 10 Tropfen einer Eisen(III)chlorid-Lösung (3 Spatelspitzen festes Eisen(III)chlorid in 10 mL Wasser gelöst) versetzt. Um die gewünschte Tinte zu erhalten werden noch 4-5 Spatelspitzen Gummi arabicum hinzugegeben.
Erklärung:
Rotkohl enthält Cyanidine, welche gut wasserlöslich sind. Cyanidin ist eine Farbsäure, die zudem stark pH-Wert abhängig ist. Je nach pH-Wert der Tinte kann die Farbe also auch angepasst werden. Durch das Erwärmen der Lösung werden die Cyanidine möglichst gut aus dem Rotkohl extrahiert und in Lösung gebracht. Versetzt man nun diese Lösung mit Eisenionen und einem Bindemittel, entsteht ein auf Papier haftendes Gemisch, also eine schreibfähige Tinte.
6-5. Tinte aus Rotwein
Benötigte Materialien:
Rotwein (Spätburgunder Qualitätswein trocken), Becherglas (600 mL), Siedestab, Keramikplatte, Brenner (Teklu), Dreifuß, Eisen(III)chlorid, Gummi arabicum, Schnelllauftrichter, Filterpapier, Tondreieck, Pasteur- Pipette
Versuchsaufbau:
Der Versuchsaufbau ist der gleiche wie zuvor bei 6.1 Tinte aus schwarzem Tee, mit dem Unterschied, dass lediglich 100 mL Rotwein in das Becherglas gegeben werden.

größere Ansicht
Abb. 19: Versuchsaufbau zum Versuch "Tinte aus Rotwein"; erstellt von Oliver Odenbach
Durchführung:
100 mL Rotwein werden in einem Becherglas kurz aufgekocht. Nach dem Abkühlen wird die Lösung in ein anderes Gefäß filtriert (siehe Abb. 20) und mit 5-10 Tropfen Eisen(III)chlorid-Lösung (3 Spatelspitzen festes Eisen(III)chlorid in 10 mL Wasser gelöst) versetzt. Diese nun schwarz gewordene Lösung wird mit 4-5 Spatelspitzen Gummi arabicum versetzt und gut geschüttelt.

größere Ansicht
Abb. 20: Filtration von Rotwein; erstellt von Oliver
Odenbach

größere Ansicht
Abb. 21: Tinte aus Rotwein auf Papier; erstellt von Oliver Odenbach
Erklärung:
Der wichtigste Bestandteil eines Rotweins ist das Tannin. Tannin ist ebenfalls ein Gerbstoff und kann somit auch zur Herstellung einer Tinte herangezogen werden. Durch das Kochen und Filtrieren des Weines werden die Trübstoffe abgetrennt, sodass eine klarere Tinte hergestellt werden kann (siehe Abb. 20). So bildet auch das Tannin bei der Zugabe von Eisen(III)-Ionen einen blau-schwarzen Komplex. Diese Lösung wird durch Zugabe des Bindemittels Gummi arabicum zu einer schreibfähigen Tinte.
6-6. Tinten aus Tannin
[12] Www.axel-schunk.de, entnommen am 29.01.2017
Vorab ist zu erwähnen, dass der Unterschied zu der aus dem Tannin des Rotweins hergestellten Tinte darin besteht, dass bei den folgenden 2 Experimenten Tannin als reiner Feststoff verwendet wurde und zur Bildung des Komplexes mit dem Gerbstoff einmal CuSO4 und einmal FeSO4 verwendet wurden, um die verschiedenfarbigen Komplexe, die entstehen können, aufzuzeigen.
Benötigte Materialien:
Tannin, Eisen(II)sulfat, Kupfer(II)sulfat, Wasser, Becherglas (600mL), Gummi arabicum
Durchführung:
3g Tannin werden in 250 mL Wasser gelöst. Die Hälfte der Lösung (125 mL) wird mit 4g FeSO4 versetzt, die andere Hälfte mit 4g CuSO4. Zu diesen Lösungen werden je 2,5g Gummi arabicum gegeben.

größere Ansicht
Abb. 22: Links: Tannin + FeSO4; rechts: Tannin + CuSO4; erstellt von Oliver Odenbach
Erklärung:
Auch mit Eisen(II)-Ionen bilden die Gerbstoffe einen Komplex. Hierbei wird aber erst an der Luft erkennbar, was diese Tinte eigentlich ausmacht. Fe2+ ist autoxidabel und oxidiert somit an Luft zu Fe3+. Es bilden sich dunkle Eisen(III)gallate, wodurch die Tinte nach dem Auftragen auf Papier mit der Zeit immer dunkler wird, bis sie eine annähernd schwarze Farbe angenommen hat.
Die Zugabe von CuSO4 hat in diesem Zusammenhang jedoch nur einen experimentellen Wert, da dieses früher teilweise ebenfalls zur Tintenherstellung verwendet wurde. Zudem soll so auch gezeigt werden, dass es zwar möglich ist eine Tinte mit Zusatz von CuSO4 herzustellen, die Wirkung von FeSO4 auf dem Papier jedoch deutlich intensiver ist. Heutzutage wird deshalb zumindest fast ausschließlich FeSO4 zur Herstellung von Tinten aus Gerbstoffen verwendet.
Im direkten Vergleich der experimentell hergestellten Tinten sieht man, dass die Farben der Tinten sich deutlich voneinander unterscheiden und diese auch das Papier völlig unterschiedlich färben.

größere Ansicht
Abb. 23: Tinten aus Tannin mit verschiedenen Zusatzstoffen; erstellt von Oliver Odenbach
6-7. Berliner Blau
Benötigte Materialien:
Gelbes Blutlaugensalz (K4[Fe(CN)6]), Eisen(III)chlorid, 2 Bechergläser (600 mL)
Durchführung:
Es werden aus K4[Fe(CN)6] und FeCl3 Lösungen hergestellt und in einem Stoffmengenverhältnis 1:1 miteinander gemischt. Um nach dem Mischen ein möglichst konzentriertes und viskoses Ergebnis zu erhalten, wurde ein Mischungsvolumen von 20 mL gewählt. So wurden von beiden Lösungen je 10 mL hergestellt, also mussten ungefähr 3,7 g K4[Fe(CN)6] und 1,6 g FeCl3 eingewogen und gelöst werden. Die Eisen(III)chlorid- Lösung wurde zur K4[Fe(CN)6]-Lösung zugegeben. Es bildet sich eine königsblaue Lösung, das Berliner Blau.
Erklärung:
Versetzt man eine Lösung von gelbem Blutlaugensalz mit einer in Wasser gelösten Eisen(III)-Salzlösung im Molverhältnis 1:1 entsteht das kolloidal gelöste Berliner Blau.
Fe3+ + K4[FeII(CN)6] → 3K+ + K[FeIIIFeII(CN)6] lk
Ein gleiches Ergebnis wäre demnach theoretisch auch zu erwarten, wenn man eine Lösung von rotem Blutlaugensalz2 mit einer in Wasser gelösten Eisen(II)-Salzlösung im Molverhätlnis 1:1 mischt.
Fe2+ + K3[FeIII(CN)6] → 2K+ + K[FeIIIFeII(CN)6]

größere Ansicht
Abb. 24: Berliner Blau auf Papier; erstellt von Oliver Odenbach
6-8. Eisengallustinte
Www.axel-schunk.de, entnommen am 29.01.2017
Vorab ist zu erwähnen, dass aufgrund des historischen Stellenwerts der Eisengallustinte und des besonders gut sichtbaren Effekts des "Nachdunkelns" viele Versuche mit dieser durchgeführt wurden. So wurde mit den Konzentrationen der Gallussäure und der Eisensalzlösung, der Auswahl der Zugabe des Eisensalzes und sonstiger Reagenzien experimentiert, um den optischen Effekt des "Nachdunkelns" zu optimieren, beziehungsweise um gezielt Einfluss auf diesen Effekt haben zu können.
Benötigte Materialien:
Gallussäure (aus Galläpfeln oder Eichenrinde), Eisensalzslösung (FeCl3, FeSO4 oder (NH4)2Fe(SO4)2), Becherglas, Wasser
Allgemeine Durchführung:
Zu einer Lösung aus Gallussäure werden Eisenionen gegeben und mit Gummi arabicum als Bindemittel versetzt.
Erklärung:
Die Gallussäure bildet mit Eisen(III)-Ionen einen blau-schwarzen Komplex, welcher schwerlöslich ist. Nach dem Abfiltrieren der dunklen Niederschläge und der Zugabe von Gummi arabicum als Bindemittel, erhält man die Eisengallustinte, welche sehr dunkel und intensiv auf Papier schreibt. Im Allgemeinen kann man sagen: Je höher die Konzentration der zugegebenen Eisen(III)-Ionen, desto dunkler und intesiver wird der Farbauftrag auf dem Papier.
Um den Effekt der Autoxidation von Fe2+ zu Fe3+ an der Luft zu erzielen, kann der Versuch nach obiger Anleitung mit anschließender Zugabe eines Reduktionsmittels, wie zum Beispiel Ascorbinsäure durchgeführt werden. Dies bewirkt das jegliches Fe3+ in der Lösung zu Fe2+ reduziert wird. Nach dem Auftragen dieser Tinte auf Papier oxidiert das Fe2+ am Luftsauerstoff wieder zu Fe3+. Fe3+ bildet dunkle Eisen(III)gallate, wodurch die Tinte langsam immer dunkler wird.
2FeO + ½O2 → Fe2O3
Im Umkehrschluss daran lässt sich erkennen, dass Ascorbinsäure ein geeigneter Tintenkiller für Tinten ist, die die dunkle Farbe der Eisen(III)gallate als Basis der Schreibfähigkeit benutzen, da das Fe3+ wieder zu Fe2+ reduziert wird, welches farblos auf Papier ist.

größere Ansicht
Abb. 25: Eisengallustinte mit Zugabe von FeCl3; erstellt von Oliver Odenbach

größere Ansicht
Abb. 26: HCl als Tintenkiller; erstellt von Oliver Odenbach
Experimentell wurde dieser Befund ebenfalls bewiesen, indem eine mit Eisengallustinte beschriebene Fläche mit einer verdünnten HCl-Lösung bestrichen wurde. Die Eisengallustinte wurde in einem anderen Versuch mit einer gesättigten Gallussäure- Lösung hergestellt, indem FeSO4 zugegeben wurde. Interessant bei diesem Versuch war, dass der Effekt des Nachdunkelns auf dem Papier umso länger dauerte, je weniger Eisen(II)-Ionen der Gallussäure-Lösung zugesetzt wurden. Dies liegt daran, dass an der mit der Eisengallustinte beschriebenen Oberfläche viel weniger Eisen(II)-Ionen vorliegen, die zu Fe3+ oxidieren könnten. So hat es bis zu 15 Sekunden nach dem Auftragen der Tinte gedauert, bis eine Dunkelfärbung auf dem Papier erkennbar wurde. Da der Luftsauerstoff für die Oxidation des Eisens verantwortlich ist, schlug Herr Prof. Dr. Menzel vor, ein Papier mit der Eisengallustinte unter Schutzgas zu beschreiben. Für diesen Versuch wurde ein Erlenmeyer-Kolben, worin sich ein Stück Papier befindet, mit Stickstoff durchgespült. Unter diesem Schutzgas aus Stickstoff wurde das Papier nun mit der Eisengallustinte beschrieben. Der Effekt des Nachdunkelns verzögerte sich hierbei sehr stark, da kein Luftsauerstoff mehr für die Oxidation von Fe2+ zu Fe3+ zur Verfügung stand. Erst als der Stickstoff langsam in die Laborluft entwich und der Sauerstoff an die Oberfläche des beschriebenen Blatt Papiers gelangte, wurde die Schrift sichtbar.

größere Ansicht
Abb. 27: Eisengallustinte mit Zugabe von FeSO4; erstellt von Oliver Odenbach

größere Ansicht
Abb. 28: Bildung der Stickstoff-Schutzgasatmosphäre; erstellt von Oliver Odenbach
7. Geheimtinten
7-1. Zitronensaft
Benötigte Materialien:
Zitrone, kleines Gefäß (z.B. kleines Becherglas, Keramiktiegel), Messer, Keramikplatte, Papier, Feuerzeug
Durchführung:
Die Zitrone wird mit dem Messer halbiert. Anschließend den Saft aus der Zitrone ausdrücken und in einem kleinem Gefäß auffangen. Mit dem Saft wird nun eine Botschaft auf ein Papier geschrieben. Nach dem Trocknen wird die beschriebene Stelle vorsichtig mit einem Feuerzeug erhitzt. Achtung, dass das Papier dabei nicht anfängt zu brennen!

größere Ansicht
Abb. 29: Geheimtinte aus Zitronensaft; erstellt von Oliver Odenbach
Erklärung:
Zitronensaft enthält Zitronensäure. An der auf dem Papier mit dem Zitronensaft beschriebenen Stelle greift die Säure das Papier an, wodurch sich das Papier schneller zersetzt. Wenn die beschriebene Stelle zusätzlich erhitzt wird, wird dieser Vorgang beschleunigt. So nimmt das Papier durch die thermische Zersetzung die Braunfärbung an (siehe Abb. 31).

größere Ansicht
Abb. 30: Papier mit Zitronensaft vor der thermischen Zersetzung; erstellt von Oliver Odenbach

größere Ansicht
Abb. 31: Papier mit Zitronensaft nach der thermischen Zersetzung; erstellt von Oliver Odenbach
7-2. Knoblauchsaft und Alaun
[11] KRAHL und DUCCI, 2013, S. 166
Benötigte Materialien:
2 Knoblauchzehen, Knoblauchpresse, Feuerzeug, Alaun (KAl(SO4)2*12H2O), 2 Bechergläser (50 mL)
Durchführung:
2g Knoblauch werden in der Knoblauchpresse gepresst und der Saft mit 5 mL Wasser in einem Becherglas versetzt. Dazu wird 1 mL einer Alaun-Lösung (w(KAl(SO4)2*12H2O) = 5%) gegeben. Mit einem Pinsel wird mit dieser Lösung nun eine Botschaft auf ein Papier geschrieben. Nach dem Trocknen ist die Zeichnung unsichtbar und wird mit einem Feuerzeug erhitzt, wodurch die Botschaft in dunkler Farbe erkennbar wird.

größere Ansicht
Abb. 32: Geheimtinte aus Knoblauchsaft und Alaun auf Papier; erstellt von Oliver Odenbach
Erklärung:
Für die Sichtbarmachung der Schrift gilt hier wie beim Versuch 7.1 Zitronensaft das Prinzip der thermischen Zersetzung. Die Lösung aus Knoblauchsaft und Alaun hat einen sauren Charakter, welcher auf den Aluminiumionen beruht, die als Kationensäure wirken:
[Al(H2O)6]3+ + H2O ⇆ [Al(H2O)5OH]2+ + H3O+
Die Cellulose des Papiers wird durch die saure Lösung hydrolysiert. Diese benetzten Stellen auf dem Papier werden auf dem Papier leichter thermisch zersetzt, wodurch schwarze Zersetzungsprodukte der Cellulose entstehen. Das Papier wird an den beschriebenen Flächen braun-schwarz (siehe Abb. 32). In Abb. 32 wurde zum Vergleich der obere Rand des Papiers noch kurz angezündet, um die Zersetzungsprodukte der Cellulose ohne Auftragen einer Tinte zu zeigen. Die Farbe der Knoblauch/Alaun-Lösung hat aber noch einen schwarzen Charakter. Das beruht darauf, dass auch der Knoblauch Zersetzungsprodukte liefert und ebenfalls zur Verfärbung beiträgt.
7-3. Stärke-Lösung
[11] KRAHL und DUCCI, 2013, S. 165
Benötigte Materialien:
Stärke-Lösung (w = 1%), Iod-Kaliumiodid-Lösung (c(KI*I2) = 0,05 mol*L-1), stärkefreies Papier (Royal Parchment Zartblau von Papier Direkt), Wattepads
Durchführung:
Mit einer Stärkelösung, w = 1%, wird auf das Pergament geschrieben und die Schrift trocknen gelassen. Nach dem Trocknen tupft man mit einem Wattepad die Iod- Kaliumiodid-Lösung darauf. Die vorher mit der Stärke-Lösung beschrifteten Flächen erscheinen in schwarz-blauer Farbe, die nicht beschriebenen Flächen werden braun.

größere Ansicht
Abb. 33: Iod-Stärke-Komplex auf Pergament; erstellt von Oliver Odenbach
Erklärung:
Iod bildet mit Stärke-Lösung einen blauen Iod-Stärke-Komplex. Die Blaufärbung entsteht dadurch, dass die Polyiodidketten (I3-, I5-, I7-, I9-) sich in den Hohlraum der Amylosehelix einlagern. Betupft man die mit Stärke-Lösung beschrifteten Flächen mit der Iod- Kaliumiodid-Lösung, entsteht an den entsprechenden Stellen der blaue Iod-Stärke- Komplex. Da die Iod-Kaliumiodid-Lösung eine bräunliche Farbe hat, verfärbt sich die nicht mit Stärke-Lösung bestrichene Fläche auf dem Pergament braun (siehe Abb. 33). Der Versuch kann ebenfalls durchgeführt werden, indem man die Iod-Kaliumiodid-Lösung nicht auf die mit Stärke-Lösung beschriebene Fläche tupft, sondern indem man das mit Stärke-Lösung beschriebene Pergament in eine Kammer mit Iod-Dampf legt.
Ein interessanter Aspekt ergab sich, als der Versuch zunächst auf "normalem" Papier aus dem Handel versucht wurde. Als mit der Iod-Kaliumiodid-Lösung auf dieses Papier geschrieben wurde, bildete sich sofort der Iod-Stärke-Komplex. Damit wurde nachgewiesen, dass sich (in den meisten Fällen) Stärke in Papier befindet und somit einfach eine Iod-Kaliumiodid-Lösung als Tinte verwendet werden könnte (siehe Abb. 35).

größere Ansicht
Abb. 34: Iod-Kaliumiodid-Lösung auf "normalem" Papier; erstellt von Oliver Odenbach
Ebenfalls interessant ist, dass eine Natriumthiosulfat-Lösung als Tintenkiller für den Iod- Stärke-Komplex herangezogen werden kann. Durch Natriumthiosulfat wird Iod nämlich reduziert, wodurch der blaue Iod-Stärke-Komplex zerstört wird.
I3- (im Komplex gebunden) + S2O32- → 3I- + S4O62-
7-4. Eisen(III)chlorid-Lösung
[11] KRAHL und DUCCI, 2013, S. 164f.
Benötigte Materialien:
Eisen(III)chlorid, Ammoniumthiocyanat, Gallussäure, gelbes Blutlaugensalz, Wattepads, Papier, Wasser, Pinsel
Durchführung:
Ein Papier wird mit einer verdünnten Gallussäure-, einer Ammoniumthiocyanat- und einer K4[Fe(CN)6]-Lösung bemalt und nach dem Trocknen mit einem mit Eisen(III)chlorid- Lösung befeuchteten Wattepad betupft. Die mit Gallussäure beschriebene Fläche wird schwarz sichtbar, die mit Ammoniumthiocyanat beschriebene Fläche wird rot und die mit K4[Fe(CN)6] beschriebene Fläche wird blau.
Erklärung:
Wie in obigen Ausführungen bereits erwähnt wurde bildet FeCl3 mit Gallussäure einen blau-schwarzen Komplex und mit K4[Fe(CN)6] entsteht Berliner Blau. FeCl3 bildet nach dem Befeuchten mit Ammoniumthiocyanat-Lösung den roten Triaquatrithiocyanatoeisen(III)-Komplex:
FeCl3 + 3H2O + 3SCN-⇆ [Fe(SCN)3(H2O)3] + 3Cl-
Das vorher unbeschrieben zu scheinende Pergament enthüllt nach dem Behandeln mit der Eisen(III)chlorid-Lösung seine geheime Botschaft (siehe Abb. 35 + 36)

größere Ansicht
Abb. 35: NH4SCN-Lösung (auf Papier getrocknet) nach der Behandlung mit einer FeCl3-Lösung; erstellt von Oliver Odenbach

größere Ansicht
Abb. 36: Gallussäure-Lösung (auf Papier getrocknet) nach Behandlung mit einer FeCl3-Lösung; erstellt von Oliver Odenbach
7-5. Kupfersulfat-Lösung
[11] KRAHL und DUCCI, 2013, S. 164
Benötigte Materialien:
Kupfersulfat-Pentahydrat (CuSO4*5H2O), konzentrierter Ammoniak (w(NH3)=25%), Papier, kleines Gefäß (benutzt wurde eine leere 100er Tic Tac Dose), Wasser
Durchführung:
Aus dem Kupfersulfat wird eine Lösung mit c(CuSO4) = 0,05 mol * L-1 hergestellt. Mit dieser Lösung wird nun auf Papier geschrieben und die Schrift trocknen gelassen. Nun wird das Papier in die leicht mit konzentriertem Ammoniak befüllte Tic Tac Dose gehalten. Die vorher nicht sichtbare Schrift wird blau.

größere Ansicht
Abb. 37: Mit Kupfsulfat-Lösung beschriftetes Pergament vor Behandlung mit Ammoniakdämpfen; erstellt von Oliver Odenbach

größere Ansicht
Abb. 38: Mit Kupfersulfat-Lösung beschriftetes Pergament nach Behandlung mit Ammoniakdämpfen; erstellt von Oliver Odenbach
Erklärung:
Die niedrige Konzentration der CuSO4-Lösung wird benötigt, damit die blaue Farbe des Kupfertetraaqua- Komplexes nach dem Trocknen auf dem Papier nicht erkennbar ist. Kupfersulfat-Pentahydrat bildet mit Ammoniak den Kupfertetrammin-Komplex:
CuSO4*5H2O + 4NH3 → [Cu(NH3)4]SO4*H2O + 4H2O
Der gebildete Kupfertetrammin-Komplex hat eine tiefblaue Farbe und wird auf dem Papier erkennbar.
7-6. Powerade (Wild Cherry)
[11] KRAHL und DUCCI, 2013, S. 167
Benötigte Materialien:
Powerade (Wild Cherry), Becherglas (50 mL), UV-Lampe (λ = 366nm), Pergamentpapier, "Power-Entfärber-Extra Stark" von Heitmann
Durchführung:
In 20 mL Powerade werden 0,02 g Power- Entfärber gelöst, wodurch sich das ursprünglich rote Getränk entfärbt (siehe Abb. 39). Mit dieser Lösung wird auf ein Papier geschrieben. Nach dem Trocknen wird die beschriebene Fläche unter dem UV-Licht betrachtet. Die beschriebene Fläche sollte nun blau fluoreszieren.

größere Ansicht
Abb. 39: Links: Entfärbtes Powerade, rechts: Original Powerade; erstellt von Oliver Odenbach
Erklärung:
Powerade (Wild Cherry) ist mit E122 (Azorubin) gefärbt (siehe Abb. 40). Der benutzte Power-Entfärber besitzt einen Natriumdithionit-Anteil von mehr als 30%. Der Azofarbstoff Azorubin wird durch das starke Reduktionsmittel Natriumdithionit an der Azogruppe in aromatische Amine gespalten. Hierbei entsteht 4-Aminonaphthalin-1-sulfonat (siehe Abb. 41), welches in einer neutralen bzw. in einer schwach sauren Lösung unter dem UV-Licht eine blaue Fluoreszenz aufweist.
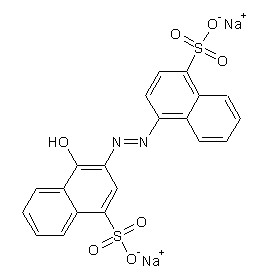
größere Ansicht
Abb. 40: Azorubin; erstellt von Oliver Odenbach mit "ChemSketch"
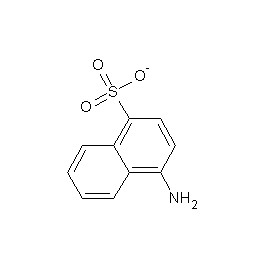
größere Ansicht
Abb. 41: 4-Aminonaphthalin-1-sulfonat; ertellt von Oliver Odenbach mit "ChemSketch"
7-7. Saubär-Badewasserfarbe
Benötigte Materialien:
Saubär-Badewasserfarbe, "Power-Entfärber - Extra Stark" von Heitmann, Wasser, UVLampe (λ = 366nm), Becherglas (600 mL)
Durchführung:
Eine Saubär-Tablette in 50 mL Wasser lösen und so lange Power-Entfärber hinzugeben, bis sich die Farbe der Lösung von orange-rot nach gelb ändert. Dabei immer sehr wenig hinzugeben und nach jeder Zugabe kräftig schütteln, sodass die verwendete Menge an Power-Entfärber möglichst gering bleibt. Mit dieser Lösung nun auf ein Papier schreiben und die beschriebene Stelle nach dem Trocknen unter einer UV-Lampe betrachten.

größere Ansicht
Abb. 42: Saubär-Badewasserfarbe, Wasser und Power-Entfärber; erstellt von Oliver Odenbach
Erklärung:
Saubär-Badewasserfarbe enthält den Azofarbstoff Cochenillerot A. Dieser Stoff wird durch das Natriumdithionit des Power-Entfärbers reduktiv gespalten, wobei, wie beim Versuch mit Powerade, 4-Aminonaphthalin-1-sulfonat entsteht. Diese Verbindung ist, durch die Bildung des Zwitterions, verantwortlich für die Fluoreszenz.
8. "Zaubertinte"
Der Begriff "Zaubertinte" wird im Rahmen dieser Projektarbeit verwendet, um Farbänderungen, die von der Tinte selbst ausgehen, zu beschreiben. Diese unterscheidet sich von der Geheimtinte in der Hinsicht, dass zum Auslösen der Farbänderung bei der Geheimtinte menschliche Einwirkungen benötigt werden.
Zu diesem Thema wurden 2 Experimente unternommen.
Für den ersten Versuch wurde eine basische Tymolphthaleïn-Lösung hergestellt, indem etwa 200 mg NaOH in 100 mL Wasser gelöst wurden und 4-5 Tropen einer Tymolphthaleïn-Lösung hinzugegeben wurden. Diese Lösung färbt sich nach der Zugabe der Tymolphthaleïn-Lösung blau. Tropft man mit dieser Lösung nun auf weiße Bekleidung, z.B. einen Labormantel, entfärbt sich dieser Farbfleck auf der Kleidung sofort. Dies liegt daran, dass Tymolphthaleïn ein Säure-Base-Indikator ist. Bei einem pH-Wert von 0-9,3 ist gelöstes Tymolphthaleïn farblos, ab einem pH-Wert von 10,5 färbt sich die Lösung blau. Da die Lösung durch das gelöste NaOH stark alkalisch ist, färbt sich die Lösung nach der Zugabe der Tymolphthaleïn-Lösung blau. Durch das Tropfen der Lösung auf den Labormantel bildet das Wasser in der Tinte, zusammen mit dem CO2 aus der Luft, Kohlensäure, wodurch der pH-Wert innerhalb weniger Sekunden auf unter 9,3 fällt, woraufhin die Tinte sich wieder entfärbt. Dieser Effekt wurde versucht in Abb. 43 wiederzugeben:

größere Ansicht
Abb. 43: Tropfen einer alkalischen Tymolphthaleïn-Lösung auf einen Labormantel
Der zweite Versuch wurde beim Experimentieren mit der Eisengallustinte entwickelt. Dazu wurde eine Gallussäure-Lösung mit lediglich 1% Ammoniumeisen(II)sulfat versetzt. Dazu wurden noch etwa 5% Ascorbinsäure gegeben und mit Gummi arabicum versetzt. Diese Lösung ist komplett farblos und dunkelt nach dem Auftragen auf das Papier nur sehr langsam nach. Nach etwa 30 Sekunden hat die Eisengallustinte jedoch die übliche intensive Schwarzfärbung erreicht.
Der Begriff Zaubertinte wird hier verwendet, da eine komplett farblose Lösung nach dem Auftragen nach einer gewissen Zeit von "alleine" nachdunkelt. Die Lösung ist farblos, da Eisen(II)-Ionen zugegeben wurden und durch die Zugabe von Ascorbinsäure als Reduktionsmittel an jeglicher Oxidation zu Fe3+ in der Lösung gehindert wurden. Außerdem ist die zugegebene Konzentration an Eisen(II)-Ionen sehr gering. Durch das Auftragen der Tinte auf ein Papier oxidiert das Fe2+, wenn auch nur sehr langsam, zu Fe3+, welches bekanntermaßen für die Dunkelfärbung der Eisengallustinte verantwortlich ist (siehe 6.8 Eisengallustinte).
Die folgende Abfolge an Fotos dient dazu, um den Effekt des Nachdunkelns dieser "Zaubertinte" annähernd visuell in der Dokumentation darstellen zu können.

größere Ansicht
Abb. 44: Nachdunkeln der Zaubertinte 1

größere Ansicht
Abb. 45: Nachdunkeln der Zaubertinte 2
größere Ansicht
Abb. 46: Nachdunkeln der Zaubertinte 3

größere Ansicht
Abb. 47: Nachdunkeln der Zaubertinte 4
9. Tusche
9-1. Kerzenruß
[13] www.chemieunterricht.de; zuletzt aufgerufen am 30.01.17
Benötigte Materialien:
Kerzenruß, Wasser, Gummi arabicum
Durchführung:
Der Kerzenruß wird mit einer gesättigten Lösung aus Gummi arabicum sehr wenig verdünnt, sodass die Konzentration der Rußpigmente sehr hoch bleibt.

größere Ansicht
Abb. 48: Tusche aus Kerzenruß; erstellt von Oliver Odenbach
Erklärung:
Ruß besteht aus sehr feinen Kohlenstoffpartikeln, welche sich nicht in Wasser lösen lassen. Um trotzdem damit schreiben zu können, muss wenig einer stark konzentrierten Bindemittel-Lösung zugegeben werden. Je mehr Lösung den Pigmenten zugesetzt wird, desto geringer wird die Deckkraft der Schrift. Kleine Rußpartikel werden beim Schreiben, durch die Wasserunlöslichkeit, zu sehen sein.

größere Ansicht
Abb. 49: Tusche aus Ruß auf Papier; erstellt von Oliver Odenbach
9-2. Asche aus Zucker
Beim praktischen Arbeiten im Labor führte ein Kommilitone einen Versuch durch, indem er gewöhnlichen Haushaltszucker anzündete. Es kam die Idee auf, aus der daraus resultierenden Asche, eine Tusche herzustellen. So wurde die Asche in einer Reibschale mit Pistill verrieben. Diese Asche wurde dann, wie der Kerzenruß, mit einer gesättigten Lösung aus Gummi arabicum versetzt, wodurch die Tusche schon schreibfähig wurde.

größere Ansicht
Abb. 50: Verriebe Asche aus Zucker; erstellt von Oliver Odenbach

größere Ansicht
Abb. 51: Tusche aus Asche auf Pergament; erstellt von Oliver Odenbach
10. Bedeutung und genereller Aufbau der Tinte
Tinten hatten für die Menschheit eine prägende Rolle. Ohne sie, wären viele alte Dokumente, auch aus vorchristlicher Zeit, nicht mehr lesbar. Auch heute spielt die Tinte eine wichtige Rolle, um Informationen nicht digital abrufen zu können. Würde es die Tinte nicht geben, wäre der Buchdruck und heutige Medien, wie der Tintenstrahldrucker, nicht denkbar. Dabei ist dessen Herstellung undenkbar einfach. Lediglich ein Gerbstoff oder ein Pigment, gemischt mit einem Eisensalz und Bindemittel, wird benötigt. Je nach Zusatz des Pigments oder des Eisensalzes, kann über die resultierende Farbe, sowie über die Deckkraft auf dem Papier entschieden werden. So könnte man aus viel mehr Naturstoffen, als den hier in dieser Arbeit aufgelisteten, Tinten herstellen.
11. Literaturverzeichnis
[1] http://www.seilnacht.com/Lexikon/flammrus.html (zuletzt aufgerufen am 29.01.17)
[2] http://www.zigzag-papers.net/de/images/savoirfaire_acacia.png (zuletzt aufgerufen am 29.01.17)
[3] http://gute-stangentusche-schlechte-tusche.blogspot.de/ (zuletzt aufgerufen am 29.01.17)
[4] http://www.kuenstlermagazin.de/Tusche-und-Tinte/Antiktusche-von-Rohrer-Klingner/Kalligraphie-Antiktusche-Bister-100ml.htm?shop=kuenstler&a=article&ProdNr=RKTU28660100&t=4185&c=9442&p=9442 (zuletzt aufgerufen am 29.01.17)
[5] http://www.kalligraphie.com/432-0-Sepia-Bistertinte.html (zuletzt aufgerufen am 29.01.17)
[6] http://www.chemie.de/lexikon/Tinte.html (zuletzt aufgerufen am 29.01.17)
[7] https://kochpoetin.wordpress.com/tag/sepiatinte/ (zuletzt aufgerufen am 29.01.17)
[8] http://www.pcwelt.de/produkte/Leistungsstarke-Allround-Drucker-Die-besten-Tintenstrahldrucker-149641.html (zuletzt aufgerufen am 29.01.17)
[9] https://www.tonerpartner.de/die-geschichte-der-tinte/ (zuletzt aufgerufen am 29.01.17)
[10] https://books.google.de (29.01.2017). TIECK, Ludwig: J. W. v. Goethe's sämtliche Werke. https://books.google.de/books?id=_qXPAAAAMAAJ&pg=PA134&dq=Die+Tinte+macht+uns+wohl+gelehrt,++doch+%C3%A4rgert+sie,+wo+sie+nicht+hingeh%C3%B6rt.++Geschrieben+Wort+ist+Perlen+gleich,++ein+Tintenklecks+ein+b31%C3%B6ser+Streich.&hl=de&sa=X&ved=0ahUKEwiNsc3DiOjRAhVMaxQKHX-3DPAQ6AEIHDAA#v=onepage&q=Die%20Tinte%20macht%20uns%20wohl%20gelehrt%2C%20%20doch%20%C3%A4rgert%20sie%2C%20wo%20sie%20nicht%20hingeh%C3%B6rt.%20%20Geschrieben%20Wort%20ist%20Perlen%20gleich%2C%20%20ein%20Tintenklecks%20ein%20b%C3%B6ser%20Streich.&f=false
[11] KRAHL, Emmanuel / DUCCI, Matthias (2013): "A German Formula". Rezepte für Geheimtinten aus den Archiven der CIA. In: CHEMKON, Band 20, Nummer 4, S. 163-168.
[12] www.axel-schunk.de (29.01.2017). SCHUNK, Axel: Experiment des Monats Juni 2000. 31.05.2000. http://www.axel-schunk.de/experiment/edm0006.html
[13] www.chemieunterricht.de (30.01.2017). BLUME, Rüdiger: Prof. Blumes Tipp des Monats April 2004. http://www.chemieunterricht.de/dc2/tip/04_04.htm
« zurück zur Übersicht - Projektarbeiten