« zurück zur Übersicht - Projektarbeiten
"Prüfung eines Guano-Düngers"
von
Karin Weischedel
Sandy Kaiser
unter Betreuung von Prof. Dr. Georg Schwedt, TU Clausthal
| 1. Definition Guano | zum Seitenanfang  |
Guano bzw. huanu kommt aus der Inka - Sprache Quechua und bedeutet Dung. Dieser Begriff wurde erstmals für Exkremente von Seevögeln verwendet, die auf den Inseln vor der peruanischen Küste leben. Es gibt auch andere Exkretionen von anderen Tierarten, worauf man den Begriff auch anwendet, wie Fledermaus- Guano, Robben- Guano, Pinguin- Guano, Kormoranen- Guano etc. Guano wird als organischer Dünger verwendet, da er Stickstoff- und Phosphorhaltig ist.
Eine andere Definition von HUTCHINSON (1950, S.3) besagt:
"The term will be used to imply a localized accumulation of excreta and egesta or their derivatives, containing material concentrated from over a wide trophophoric field onto a relatively restricted resting or breeding site".
| 2. Geschichte des Guanos | zum Seitenanfang  |
Schon im 3. und 5. Jahrhundert v. Chr. verwendete man Vogeldung zum Düngen an der Westküste Südamerikas. Bei den Arabern war das Düngern mit Vogelexkrementen von den "Guano-Inseln" im Persischen Golf schon im 12. Jahrhundert n. Chr. bekannt. Die früheste Verwendung des Düngers erfolgte schon im 3. und 5. Jahrhundert v. Chr. von den Inkas. Man glaubt, dass sie schon intensiven Handel und Landwirtschaft mit dem Guano- Dünger betrieben. Die Inseln und sogar die Vögel wurden strengstens bewacht und beschützt. Man opferte meist silbrige Gegenstände dem Gott des Guanos (Huamancantac) bevor man mit dem Abbau begann.
Der erste schriftliche Bericht über Guano-Inseln stammt von Cieza de Leon aus dem Jahre 1553. Er beschreibt Eingeborene, die den Vogelmist für die Aussaat ihrer Feldfrüchte nahmen. 1802 erfuhr Alexander von Humboldt in Lima über Guano, der zum Düngen von Feldern verwendet wurde. Er schrieb einen Brief an Klaproth über Guano. Humboldt brachte Proben sogar mit nach Europa und ließ sie untersuchen. Das Ergebnis war, dass der Guano aus tierischen Exkrementen stammt. Erst ab 1840 begann der Import von Guano- Dünger nach Liverpool.
Seit Justus von Liebig der Auffassung vertrat, dass Pflanzen Stickstoff, Phosphor und Kalisalze brauchen, um gut wachsen zu können, war der Bedarf an Düngemittel von da an groß. Der peruanische Guano war der erste Handelsdünger.
Guano legte erstmals einer großen historischen Bedeutung zu, dass man für gute Ernteerfolge konzentrierte Nährstoffe für die Pflanzen braucht.
Dies hatte zur Folge, dass Guano nun Ganzjährig abgebaut wurde und damit entstand eine sehr niedrige Neubildungsrate. Im Jahre 1909 wurde zum Schutz des Guanos und der Vögel eine Vereinigung (Compania Administradora del Guano) abgeschlossen. Die Bedeutung von Düngemitteln fand im 19. Jahrhundert großen Anklang bei den Landwirten und der Industrie. Zum Beispiel führte der Import nach Europa im letzten Viertel des 19. Jahrhunderts zu einer halben Million Tonnen Guano pro Jahr.
2.1 Stöckhardt (kleine Biographie)
Julius Adolph Stöckhardt wurde in Meißen am 04.01.1809 und starb am 04.06.1886 in Tharandt. Nach seiner Apothekerausbildung war er in Berlin und Potsdam tätig. Nebenher studierte er Pharmazie und Naturwissenschaften. Im Jahr 1847 wurde er am neu gegründeten Lehrstuhl der Agrarkulturchemie und landwirtschaftliche Technologie angestellt. Er gilt als Begründer des landwirtschaftlichen Versuchswesens, und er erkannte als erster die Bedeutung des Stickstoffes für die Pflanzenernährung. Vor allem legte er Wert auf populärwissenschaftliches Wirken, womit er die Bevölkerung, die größtenteils in der Landwirtschaft tätig war, erreichte. Er schrieb viele Bücher und Versuche für den einfachen Bürger, u. a. den Auszug "Prüfung eines Guano- Düngers".
Buch "Die Schule der Chemie" von Dr. J. A. Stöckhardt

2.2 Guano überall auf der Welt:
Eine Quelle für Guano lag auf den Chincha- Inseln vor der Küste Perus und auf den Inseln der Lobos- Gruppe. Diese Lagerstätten sind Brutstätten, die aus Exkrementen, Kadavern und Eierschalen von Seevögeln bestehen, die sich aufgrund ihrer geologischen Lage in Dünger umwandeln. Diese Exkremente haben sich in Laufe der Jahre zu riesigen Guano - Haufen angesammelt, die größer als 30 m hoch waren.
Die wichtigsten Lagerstätten befinden sich zwischen den 8. und 15. Grad südlicher Breite.
Andere Vorkommen von solchen Lagerstätten findet man in Südwestafrika, im Indisch - Pazifischen Raum, Ägypten, sowie in europäischen Gebieten, wie in Deutschland in den Nassauischen Höhlen. Sogar werden aus Fischabfälle Fisch- Guano bzw. Heringsguano gewonnen.
Die Lagerstätten bestehen meist aus drei Schichten: die oberste Schicht (gelb- braun, wenig N, viel P), die mittlere Schicht (gelb, hoher N- Gehalt weniger Phosphat), die untere Schicht (nur noch Spuren von Stickstoff vorhanden). Allgemein gilt, dass das Klima entscheidend für den Stickstoffgehalt im Boden zuständig ist. In feuchten Gebieten wird der Stickstoff schneller ausgewaschen und demnach ist der Phosphatgehalt höher.
| 3. Düngemittel allgemein | zum Seitenanfang  |
Düngemittel oder Dünger enthalten Substanzen oder Stoffgemische, die von der Pflanze essentiell benötigt werden. Diese Nährstoffe müssen aber der Pflanzen in einer geeigneten Form zur Verfügung gestellt werden. Die Aufgabe eines Düngers ist es die Pflanzen mit den Nährstoffen zu versorgen, die sie für eine gute Entwicklung und damit für hohe Erträge mit guter Qualität benötigen. Diese Nährstoffe nennt man auch Düngestoffe, die von Mikroorganismen oder andere Hilfsmittel im Boden umgewandelt werden können. Dünger enthalten neben Düngestoffe auch Ballaststoffe.
3.1 Organische Dünger
Da der Guano - Dünger neben Torf, Knochen-, Horn-, und Fischmehl und vielen weiteren zu der Klasse der Organischen Düngemittel gehört, werden wir die Wirkungsweise und die Vorteile eines organischen Düngemittels erklären, um später die Wirkung eines Guano-Düngers verstehen zu können.
Die Definition eines Organischen Düngers lautet:
Ein organisches Düngemittel muss im Gegensatz zu einem mineralischen Düngers zuerst durch das Bodenleben aufgeschlossen werden.
Grundsätzlich nehmen Pflanzen nur Nährstoffe in mineralischer Form auf, niemals in organischer Form. Deshalb übernehmen Bodenbakterien bei einem organischen Dünger, die Umwandlung der organischen Substanz in der für Pflanzen aufnehmbare (mineralische) Nährstoffe. Außerdem ist es auch die Aufgabe von den Bodenbakterien die Nährstoffe festzuhalten, da diese sonst im Boden schnell ausgewaschen werden. Deshalb enthalten ausschließlich organische Dünger auch weniger Nährstoffe im Vergleich zu Mineraldünger.
Organische Düngemittel verbessern außerdem die Struktur und den Wassergehalt in den meisten Böden, das fördert das Wurzelwachstum und es kommt zu einer erhöhten Nährstoffaufnahme, d. h. dass "die ausschließlich organischen Dünger" zwar weniger Nährstoffe enthalten, jedoch diese durch die Bodenbakterien besser festgehalten werden können und deshalb meist effektiver wirken.
Weitere Vorteile eines organischen Düngers sind außerdem folgende Aspekte: die Bodenfruchtbarkeit wird systematisch aufgebaut, die Bodenatmung wird erhöht, die Widerstandsfähigkeit von Pflanzen gegen Krankheiten verringert, dass den Aufwand für Pflanzenschutzmittel vermindert. Zugleich wird das Obst und Gemüse, welches für den Verzehr von Menschen und Tiere gesünder macht.
Und als letzter wichtiger Punkt ist noch aufzuzählen, dass ein organischer Dünger zu einer sicheren und konstanten Nährstoffverhältnissen führt.
Als Nachteil ist zu erwähnen, dass einige organische Dünger z.B. ein hochwertiger Guano Dünger nicht sehr billig sind. Aber auch bei einigen preiswerten "guten Dünger" wie z.B. Klärschlamm aus Kläranlagen ist durch seine erhöhten Schwermetallkonzentrationen nicht mehr als Organischer Dünger so sehr beliebt und wird deshalb auch meist als Sondermüll verbrannt, aber auch bei Tierabfälle wie z.B. das Knochenmehl ist nach dem Auftreten von BSE Vorsicht geboten.
| 4. Chemische Zusammensetzung des Guanos | zum Seitenanfang  |
Ein Zusammenhang zwischen den Bestandteilen des Guanos und der Nahrungsweise von den Seevögeln ist hier gut zu erkennen:
Die Seevögel ernähren sich nur von Fischen, deshalb ist der Guano reich an Eiweiß- und Phosphaten. Die Vogelexkremente sind reichlich an stickstoffhaltiger Harnsäure, Ammonoxalat, Ammoncarbonat, Ammonphospat und anderen Ammoniumsalze (Sulfat und Chlorid).
Der Stickstoffgehalt ist leicht löslich in Wasser und man findet einen erhöhten Wert in den wärmeren Klimagegenden, einen hohen P2O5 - Wert gibt es in feuchteren Klimagegenden.
Eine braune Farbe und lockere Struktur kommt von großen Mengen des schwerlöslichen Tricaliumphosphates, dass aus ausgelaugtem Guano entsteht, dieser ist stickstoffarm.
Der Vogel- Guano, der Kormorane wurde mit einem strengen Eigengeruch beschrieben, dass auf die Ernährung von Fischen zurückzuführen ist. Der Fledermaus- Guano gibt den Boden nur langsam und gleichmäßig die Nährstoffe ab, und ist daher synthetischen Düngemitteln vorzuziehen.
Peru- Guano:
Bestandteile eines Peru - Guanos: nach Stutzer
11 bis 16 % N, 8-12% P2O5, 2 bis 3 % K20.
| Bestandteil | Anteil |
| Ammoniumoxalat | 17,73% |
| Harnsaures Ammonium | 12,20% |
| Magnesiumammoniumphosphat | 11,63% |
| Ammoniumchlorid | 2,25% |
| Ammoniumphophat | 6,90% |
| Ammoniumcarbonat | 0,80% |
| Ammoniumhumat | 1,06% |
| Phosphorsaurer Kalk | 20,16% |
| Calciumoxalat | 1,30% |
| Calciumcarbonat | 1,65% |
| organ. Substanz | 8,26% |
| Kaliumsulfat | 4,00% |
| Natriumsulfat | 4,92% |
| Kochsalz | 0,40% |
| Diverses und Wasser | 6,74% |
| 5. Übersicht der untersuchten Guano - Düngemittel | zum Seitenanfang  |
5.1 Anwendung des Guano's früher mit Mengenangaben:
"Aus Anwendung des Guano als Dünger auf praktische in England gewonnene Resultate begründet" aus Elberfeld gedruckt bei Julius Schellhoff 1845
"Die Menge, in welcher der Guano angewandt werden muß, wird nothwendigerweise nach der Verschiedenheit der Saat und Vegetation bestimmt, und nach der Jahreszeit, dem System der Erndte, und dem Zustande des Bodens und seiner frühern Behandlung. Die Anwendung wird demnach von 2 - 8 Zentner pr. imperial Acker (1 ½ Morgen Preußisch), wenn er allein gebraucht wird, variiren. [...] Der Dünger kann entweder ausgebreitet oder in Reihen gesäet werden [...]"
5.2 Heutige Anwendung
(Produkte siehe Anhang)
1. COMPO Tomatendünger plus Guano
Organisch- mineralischer Dünger NPK - Dünger mit Magnesium (9+6+15(+4))
Zusammensetzung des Düngemittel (Verpackungsangaben):
| 9% N | Gesamtstickstoff |
| 6% P2O5 | Gesamtphosphat |
| 15% K2O | wasserlösliches Kaliumoxid |
| 4% MgO | wasserlösliches Magnesiumoxid |
| 30% organische Substanz in der Trockensubstanz | |
Ausgangstoffe: Seevogelguano, Traubenkernschrot, Harnstoff, Diammonphosphat, Kaliumsulfat, Kieserit
Anwendungsgebiete: der hohe Kali-Anteil ist verantwortlich für eine gute Fruchtbildung und wird deshalb auch als Spezialdünger für Tomaten, Gurken etc. vermarktet.
Bewertung: Sehr gute Nährstoffversorgung; jedoch dreifach so teuer wie vergleichbarer Tomatendünger.
2. Floraplus Tannen- und Koniferendünger mit echtem Guano
Spezialdünger für Nadelgehölze und Immergrüne
Organisch-mineralischer NPK- Dünger mit Magnesium (7+4+5(+2))
Zusammensetzung
| 7% N | Gesamtstickstoff |
| 4% P2O5 | Gesamtphosphat |
| 5% K2O- | wasserlösliches Kaliumoxid |
| 2% MgO | wasserlösliches Magnesiumoxid (entsprechen ca. 4,2% MgCO3) |
| 40% organische Substanz in der Trockensubstanz | |
Ausgangsstoffe: Kakaoschalen, Calciumcarbonat, Harnstoff, Rohphosphat, Kaliumsulfat, Magnesiumoxid, Guano
Anwendungsgebiet: Tannen und andere Nadelgehölze, da durch den erhöhten Einsatz von Magnesium werden die Nadeln gegen eine Braunfärbung wirksam geschützt. (Verpackung)
Bewertung: Der Magnesium Wert könnte als Tannendünger etwas höher liegen! - günstigster gefundener Guano-Dünger.
3. Floraplus Beerendünger mit echtem Guano
(Spezialdünger für Beeren-Stein und Kernobst)
Organisch-mineralischer NPK- Dünger (4+4+6+(+2))
Zusammensetzung
| 4% N | Gesamtstickstoff |
| 4% P2O5 | Gesamtphosphat |
| 6% K2O | wasserlösliches Kaliumoxid |
| 2% MgO | wasserlösliches Magnesiumoxid |
| 40% organische Substanz in der Trockensubstanz | |
Ausgangsstoffe: Kakaoschalen, Urgesteinsmehl, Rohphosphat, Kaliumsulfat, Harnstoff, Magnesiumoxid, Guano
Anwendungsgebiet: Erdbeeren und andere Beerenobstsorten, sowie Kernobst.
Bewertung: Könnte als Beerendünger etwas mehr Nährstoffe vor allem Kalium enthalten, ähnliche Zusammensetzung wie der floraplus Tannendünger, sowie gleicher Preis wie der Tannendünger.
4.Gärtner's Rosendünger mit Guano und Hornmehl
Organisch - mineralischer NPK - Dünger 5+10+8(+2)
Zusammensetzung
| 5% N | Gesamtstickstoff |
| 10% P2O5 | Gesamtphosphat |
| 8% K2O | wasserlösliches Kaliumoxid |
| 2% MgO | wasserlösliches Magnesiumoxid |
| 55% Humusbildende Bestandteile | |
Ausgangsstoffe: Hornmehl, Guano, Knochenmehl, Harnstoff, Kaliummagnesia, Rohphosphat
Anwendung: Rosen sowie auch Beeren, Obst und Feingemüse (Verpackung)
Bewertung: gute Nährstoffversorgung zu einem günstigen Preis.
5. Compo Düngestäbchen mit Guano für Tomaten bzw. 6. Compo Düngestäbchen mit Guano für Grünpflanzen
Düngestäbchen - 100 Tage Langzeitwirkung
gleiche Zusammensetzung, jedoch unterschiedliche Verpackung mit unterschiedlichen Angaben für die Verwendung.
Zusammensetzung
Organisch- mineralischer Dünger (11+4+8(+2))
| 11% N | Gesamtstickstoff |
| 4% P2O5 | Gesamtphosphat |
| 8% K2O | wasserlösliches Gesamtkaliumoxid |
| 0,04% Kupfer | |
| 0,05% Mangan | |
| 0,04% Zink | |
| 60% Organische Substanz in der Trockensubstanz | |
Ausgangsstoffe: Seevogelguano, mineralischer NPK -Dünger, Bindemittel.
Anwendungsgebiete: Pflanzen in Blumentöpfen, sowie Tomaten die in Töpfen aufwachsen., Durch die Langzeitwirkung (3. Monate), werden die Haupt- und Spurennährstoffe bedarfsgerecht an die Pflanze weitergegeben; Über- und Unterdüngung werden somit verhindert.
Bewertung: Gute Versorgung von Haupt- und Spurenelemente auf längere Weise, sowie einfache Dosierung; jedoch sehr teuer für nur 30 g oder 25 Düngestäbchen. Außerdem werden die "100 Tage Langzeitwirkung", nach eigener Erfahrungen etwas übertrieben.
| 6. Hauptnährstoffe für Pflanzen | zum Seitenanfang  |
Pflanzen benötigen insgesamt 6 Hauptnährstoffe für Ihren Aufbau, dazu gehören die 3 Nichtmetalle Stickstoff, Phosphor und zuletzt Schwefel, der je nach Vorkommen und Verwendung auch als Spurenelement gezählt werden kann.
Als Metalle können dabei Kalium, Magnesium und Calcium genannt werden.
Wasserstoff und Sauerstoff werden als CO2 und H2O bei der Photosynthese verarbeitet, gelten jedoch nicht als Hauptnährstoffe der Pflanzen.
Diese Stoffe sind für das Wachstum und das Überleben einer Pflanze unbedingt notwendig. Das Fehlen eines Elementes kann nicht durch den Überschuss eines anderen kompensiert werden. In einer Pflanzen müssen die Ionen in einer verwertbaren Form vorliegen, unbrauchbar ist z.B. elementares Kalium oder elementarer Schwefel, dass sogar die Pflanze in größeren Konzentrationen schädigen oder "umbringen" würde.
Deshalb werden auch stets die verschiedenen Verbindungen der Elemente gemeint, wenn wir z.B. von einem Calciummangel sprechen.
Die Aufgaben der einzelnen Hauptnährstoffe sowie der Mangel eines Hauptnährstoffes wird in folgender Tabelle kurz aufgestellt.
| Nährstoff | Nutzen in der Pflanze | Mangelerscheinungen |
| Stickstoff (N) | zum Aufbau des pflanzlichen Eiweißes, Förderung des Wachstums, wichtig bei der Photosynthese | es kommt zu Verfärbungen, Verringerungen der vegetativen Entwicklung |
| Phosphor (P) | wichtig für den Stoffwechsel, Blüten, Samen und Fruchtbildung | ungünstige Entwicklung von Blüten, Samen und Früchten |
| Kalium (K) | erhöht die Frosthärte, festigt das Gewebe, die Wasseraufnahme, die Größe und der Geschmack der Früchte | Verkümmerungen von Pflanzen Verwelkung sowie schlaffe Blätter |
| Calcium (Ca) | Baustein für die Zellwände, reguliert den Wasserhaushalt, wirksam gegen Bodenversauerung [Kalk(CaCO |
Übersäuerung von Böden Pflanzenwachstum kann bei Calciummangel gestört werden |
| Magnesium (Mg) | wichtig für viele Stoffwechselvorgänge, Bestandteil des Blattgrüns | es kommt zu Aufhellungen von Blättern, sowie Flecken von absterbenden Gewebe |
| Schwefel (S) | Bestandteile einiger Aminosäure und Proteine | Samenbildung kann unterbleiben Aufhellungen, sowie die Drehung der Blätter nach innen. |
| 7. Experimente | zum Seitenanfang  |

Düngemittel mit Guano
- Tannen - und Koniferendünger von floraplus
- Beerendünger von floraplus
- Rosendünger mit Guano und Hornmehl von Gärtner's
- Tomatendünger von compo
- Düngerstäbchen Grünpflanzen von compo
- Düngestäbchen Tomate
7.1 nach historischem Verfahren:
Aufgabenstellung / Durchführung:
Versuchsdurchführung
nach Stöchhardt aus dem Buch "Volks-Chemie für Hausfrauen und Gewerbsleute" (1860)
(diese Anweisungen sind auf reine Guano-Sorten bezogen, nicht auf Düngemischungen)
[...]das Düngemittel wird auf einem Bogen Papier ausgebreitet und in einem geheizten Zimmer so lange liegen gelassen, bis dieser lufttrocken ist, manche Guano - Sorten verlieren 20-24 % an Gewicht.[...]
Bestimmung des Trockenverlustes eines Guano-Düngers
In einer konstant gemachten Abdampfschale werden ca. genau eine bestimmte Menge der Guano Düngemittel eingewogen. Diese werden für einige Stunden in einen Trockenschrank mit einer gleichmäßigen Temperatur von 105°C gestellt und anschließend ausgewogen.
Die Differenz aus Guano-Dünger vor dem trocknen und nach dem Trocknen ergibt den Trockenverlust.
[...]Ferner kann man den Dünger durch Verbrennung prüfen, indem man 1 Lot Guano in einem Löffel, auf glühenden Kohlen so lange erhitzt bis ein weißer oder grauer Rest zurückbleibt; die guten Guano peruanischen Sorten hinterlassen 30-33 %; sie riechen während des Verbrennens stechend nach Ammoniak; die schlechteren Sorten wie verbranntes Horn.[...]
Bestimmung des Glühverlustes eines Guano-Düngemittel
Der getrocknete Guano (vom Trockenverlust) wird über eine Brennerflamme im Abzug bei 550°C vorverascht, durch ein angefeuchtetes pH - Papier wird der ausgetriebene Ammoniak nachgewiesen (dunkelgrüne Verfärbung des pH - Papier - stark alkalisch). Durch die starke Rauchentwicklung kann der Geruch nach Horn bestimmt werden.
[...]Außerdem lässt sich die Prüfung mittels Kalk in der Weise ausführen, dass man einen Löffel voll Guano und eine gleiche Menge frisch gelöschten Kalks mit Wasser übergießt und umrührt; je stärker der sich entwickelte Ammoniakgeruch isst, desto besser isst der Guano[...]
Austreibung des Ammoniaks in einem Guano-Düngemittel
Eine kleinere Menge Guano-Dünger wird ein kleines Becherglas gegeben und mit frisch gebrannten Kalk und Wasser überschüttet, da es zu keiner Ammoniakaustreibung gekommen war, wurde 4 molare Natronlauge tropfenweise hinzugegeben, jedoch entstand mit Ausnahme eines Düngers kein Ammoniakgeruch.
[...]Mit Essig übergossen darf der Guano nicht aufbrausen sonst enthält er kohlensauren Kalk[...]
Eine kleine Portion Guano- Dünger wird auf ein Uhrglas gegeben und wird einmal mit verdünnter Essigsäure und mit verdünnter Salzsäure angesäuert, und je nach dem Aufschäumen bewertet..
Auswertung, Ergebnisse:
→ mit 4 M Natronlauge:
- entstand ein stärkerer Fischgeruch und Ammoniak
- entstand ein leichter Ammoniak- Geruch
- entstand ein leichter Ammoniak- Geruch
bei den anderen entstand ein modriger Geruch
| Art | Kalkbestimmung | Essigbestimmung mit 0,3 M | Glüh-verlust *bei 550°C | Trocken-verlust bei 105°C | mit HCl, c(HCl)=10 mol/L |
| 1.) | kaum NH3 - Geruch, leichter Fisch - Geruch | sehr viel Schaumbildung | 39,5% | 7,6% | normale starke Blasenbildung |
| 2.) | kaum NH3 - Geruch, wurde aber mehr mit der Zeit | mehr Blasenbildung, viel Schaum | 42,0 % | 6,1 % | sehr starke Schaumbildung |
| 3.) | kleine Blasen, wenig NH3 - Geruch | Blasenbildung mit mäßig viel Schaum | 25,6 % | 5,4 % | starke Schaumbildung, große Blasen |
| 4.) | wenig NH3 - Geruch, leicht modrig | wenig Blasenbildung | 49,6 % | 3,2 % | Blasenbildung nur an weiße Komponenten |
| 5.) | NH3 - Geruch mehr als bei den anderen Sorten | kein Aufbrausen | 73,8 % | 5,2 % | keine Blasenbildung, wird eine schleimige Masse |
| 6.) | kein Aufbrausen | 73,8 % | 5,2 % | keine Blasenbildung, wird eine schleimige Masse |
* Der Glühverlust wurde der Trockenverlust nicht mit abgezogen, wie beschrieben im Rezept.
Reaktion Guano und Essigsäure

weitere Eigenschaften der Dünger:
| Art | Wasserlöslichkeit | Beschaffenheit |
| 1.) | weiße Körnchen lösen sich | braun, mit größeren Schalen, ähnlich dunkle Späne, weiße Kügelchen |
| 2.) | weiße Körnchen lösen sich, grobe Teilchen nicht, trübe Überstehende Lösung | braun, mit größeren Schalen, ähnlich dunkle Späne, weiße Kügelchen |
| 3.) | einige Salze lösen sich | braun, weiße und graue kugelähnlich Bestandteile, sehr fein zermahlen |
| 4.) | nicht gut wasserlöslich, einige Bestandteile lösen sich auf | grau braun, sehr fein, sandig, mit kleinen weißen Kügelchen |
| 5.) | verklumpt, milchig mit der Zeit | 5 cm lang, im Durchmesser 0,5 cm, hell beige poröse Stäbchen |
| 6.) | verklumpt, milchig mit der Zeit | 5 cm lang, im Durchmesser 0,5 cm, hell beige poröse Stäbchen |
| Art | Beobachtungen beim Verbrennen über den Bunsenbrenner |   |
| 1. | der entstandene Rauch hatte einen pH- Wert von 11, Geruch: nach Horn, verbranntes Eiweiß und nach Ammoniak, viel NH3 Entwicklung, Asche grau- schwarz | |
| 2. | der Rauch hatte einen alkalischen pH- Wert, viel Rauch entstand, brennt nicht schnell vollständig, erst im Muffelofen, Ammoniak- Geruch feststellbar | |
| 3. | starker Ammoniak- Geruch, auch nach Horn und stark nach Eiweiß | |
| 4. | starker Ammoniakgeruch | |
| 5./6. | verklumpten bei der Verbrennung und haben weniger nach Ammoniak gerochen |
Zusammenfassung:
Nach dem Rezept von Stöckhardt zur Unterscheidung von gutem und schlechtem Guano lässt sich jedoch nicht im ganzen Maße auf die heutigen im Handel erhältlichen Produkte zurückschließen. In den von uns untersuchten Dünger stellten wir fest, dass sowohl starker Ammoniak entsteht bei der Verbrennung, als auch ein Geruch nach Horn feststellbar war. Stöckhardt schloss den Geruch nach Horn auf eine schlechte Guano - Sorte hin. Guano ist ein organischer Dünger, der erst vom Boden selbst aufgeschlossen werden muß. Daher hat dieser Dünger eine längere Verweilzeit und eine besser Effektivität für die Pflanze zum Aufnehmen von Nährstoffen. Der Zusatz von Horn wird heutzutage bewusst in den Dünger gegeben, um eine ausreichende Nährstoffversorgung zu erreichen. Stöckhardt ging wahrscheinlich von reinem Peru - Guano (siehe Tabelle nach STUTZER) aus, ohne Zusätze von anderen organisch - mineralischen Komponenten.
Der Nachweis des Guanos aus der Zeit von Stöckhardt sollte einer einfachen Hausfrau die Möglichkeit geben, ihren gekauften Guano auf Reinheit zu überprüfen, um nicht eine fälschliche Mischung zu erwerben. Unsere erhaltene Mittelwerte des Trockenverlustes der Dünger liegt bei ca. 7 % und damit unter dem Wert von Stöckhardt. Der Glühverlust jedoch liegt auch um die 33 % und sind laut ihm gute Sorten. Der Grund weshalb der Trockenverlust stark abweicht, ist die unterschiedliche Zusammensetzung der Dünger von früher und heute.
Man verwendet heute mehr organisch - mineralische Dünger, je nach Einsatz des Düngers auf die jeweilige Pflanzenart. Bei der Prüfung mittels Kalk konnte man auch einen Ammoniak - Geruch feststellen, am stärksten war der Geruch beim Tomatendünger, d.h. er ist in unserer Untersuchungsreihe der beste Dünger auf den Stickstoffgehalt (nach Stöckhardt's Rezept). Stöckhardt ging in seinem Rezept nur auf den Hauptnährstoff Stickstoff aus und teilte die Dünger danach ein. Man muß dazu noch erwähnen, dass Phosphorverbindungen, Kaliumsalze usw. auch wichtig sind für die Nährstoffversorgung der Pflanze. Der Tomatendünger und die Düngestäbchen schäumten sehr wenig bei der Zugabe von Essigsäure auf. Darauf kann man schließen, dass die Dünger wenig "kohlensauren Kalk" enthalten. Die übrigen Dünger reagierten unter meist heftiger Schaumbildung mit Essig, d.h. sie sind laut Stöckhardt nicht gut in Anwendung als Düngemittel. Bsp. der Tannendünger hat zu viel "kohlensauren Kalk", da Tannen auf saure Böden schlechter gedeihen. Damit dient der saure Kalk als Puffer für den Boden.
Heutzutage kann man die Angaben nach Stöckhardt auf die Qualität eines guten Guanos nicht mehr übertragen.
7.2 nach heutigem Verfahren:
7.2.1 Kaliumbestimmung
Durchführung:
Flammenphotometrisch:
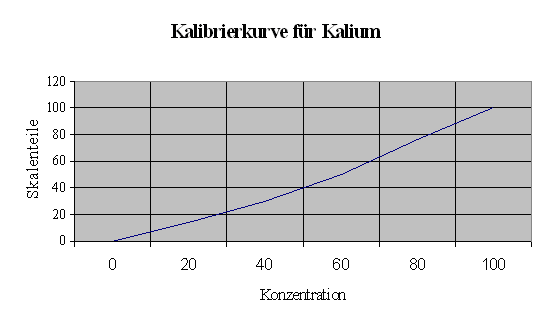
Man erstellt zuerst eine Kalibrierkurve, dazu wird eine Standardlösung mit den Konzentrationen 100 mg/L; 80mg/L; 60mg/L; 40mg/l; 20mg/L und 0mg/L Kalium hergestellt. Dazu wird Kaliumchlorid mit dem Umrechnungsfaktor auf Kalium umgerechnet, und entsprechend die Masse an Kaliumchlorid eingewogen, die Konzentration wird gegen Skaleneinteilung am Flammenphotometer mit Kaliumfilter aufgetragen (SKT. 0 bis100).
Gemessen am Flammenphotometer St; Dr. B. Lange mit Kaliumfilter [220 V ~ (Azetylen)]
Durchführung:
5,00 g Guano- Dünger werden zuerst abgewogen und mit 100 ml CAL- Lösung (Extraktionsmittel) eine Stunde extrahiert.
Anschließend wird die Lösung filtriert, und verdünnt 1 ml auf 99 ml CAL- Lösung, bevor es am Flammenphotometer gemessen werden konnte.
Als Nullpunkteinstellung wurde reine CAL - Lösung verwendet.
Die SKT. werden an der erstellten Kalibrierkurve abgelesen, und als K2O umgerechnet.
Außerdem wird der Verdünnungsfaktor berücksichtigt und das enthaltene K2O mit dem
Verdünnungsfaktor auf die Einwaage des Düngers.
Flammenphotometer

Auswertung
Kalibrierkurve
Es wurden 190,7 mg KCl auf 1L mit CAL- Lösung versetzt. (man braucht 100 mg Kalium)
Auswertung:
Einwaage je genau 5,00 g Dünger
| Art | Verdünnung des Extrakts mit CAL- Lösung | Versuch | (in SKT) | Mittelwert | in g Kalium | |||
| Nr. 1.) | Nr. 2.) | Nr. 3.) | Nr. 4.) | Nr. 5.) | ||||
| 1. | 1 ml zu 99 ml | 15 | 15 | 16 | 17 | 17 | 16 | 0,222 |
| 2. | 1 ml zu 99 ml | 10 | 11 | 11 | 11 | 11 | 0,158 | |
| 3. | 1 ml zu 99 ml | 12 | 13 | 13 | 13 | 13 | 13 | 0,186 |
| 4. | 1 ml zu 99 ml | 34 | 35 | 35 | 35 | 35 | 0,423 | |
| 5. | 1 ml zu 99 ml | 12 | 13 | 13 | 13 | 14 | 13 | 0,188 |
| 6. | 1 ml zu 99 ml | 14 | 14 | 13 | 13 | 13 | 0,195 |
Der Flüssigdünger (ASB Greenworld "Flüssigdünger mit Guano") hatte bei einer Verdünnung von 1:9999 2 SKT, d.h. es liegt im Fehler der Methode.
Rechenbeispiel: für Nr. 1
Fehler der Methode: +/- 3 %
Fehler der Messreihe: +/- 4,7 % (mit 90 % Sicherheit, 5,0)
Standardabweichung: 1,095
abgelesene Konzentration aus der Kalibrierkurve für die Verdünnung:
Mittelwert 22,2 mg / 100mg Kalium
genaue Konzentration: 22,2 mg / L also 2,2 mg / 100ml von der Verdünnung
in 1 Liter Extrakt sind 0,2220 g Kalium
gefunden von 5,00 g Dünger, d.h. 4,4 % Kalium
umgerechnet auf K2O mit f = 1,2046
Gehalt an K2O ist 0,2674 g bzw. 5,3 %
| Art | Konzentration in mg / L Kalium | relative Fehler | Umrechnung in K2O | in % K2O |
| 1. | 22,2 | 4,7 % | 0,267 g | 5,3 % |
| 2. | 15,8 | 3,7 % | 0,190 g | 2,8 % |
| 3. | 18,6 | 4,6 % | 0,224 g | 4,5 % |
| 4. | 42,3 | 4,3 % | 0,512 g | 10,2 % |
| 5. | 18,8 | 5,3 % | 0,226 g | 4,3 % |
| 6. | 19,5 | 3,6 % | 0,235 g | 4,7 % |
Ergebnis:
Die untersuchten Dünger enthalten nach unserer Messungen einen Kaliumoxidgehalt um die 5 %, Ausnahme ist der Tomatendünger mit 10,2 %. Dies bedeutet die Dünger enthalten genügend Kalium.
7.2.2 Nachweis von Phosphat am Photometer
Reaktionsgleichung
| (NH4)2 Mo O4 + 2 H+ | → | H2Mo O4 + 2 NH4+ |
| 3 H2Mo O4 | → | Mo O103- + 2 H2O +2 H+ |
| H3P O4 + 4 Mo O102- + 8 H+ | → | H3[P(Mo3010)4] + 4 H20 |
Durchführung
5 g Dünger werden mit 100 ml AlK(SO4)2 - Lsg. versetzt und eine Stunde extrahiert.
10 ml Extrakt und 1 ml verd. Schwefelsäure sowie 1 ml Ammoniumperoxidisulfat werden hinzugegeben und 10 min. erwärmt. Nach dem Abkühlen werden 5 ml Ammoniummolybdatlösung sowie 5 ml Photo- Rex- Lösung. hinzugegeben, und auf 100 ml verdünnt. Nach einer Stunde wird bei 720 nm die Extinktion gemessen. Die Blindprobe wird genauso behandelt wie die Hauptprobe nur mit reines Extraktionsmittel der AlK(SO4)2 - Lösung.
Auswertung:
bei Wellenlänge: 720 nm
| Art | Einwaage | Werte Extinktion | in mg / kg P2O5 | Bemerkung | |||
| 1.) | 5,02 g | - | - | - | - | - | * |
| 2.) | 5,04 g | 1,352 | 1,324 | 1,300 | 1,302 | 1179,6 | blaue Lsg. |
| 3.) | 5,05 g | 1,460 | 1,505 | 1,510 | 1,512 | 1368,1 | blaue Lsg. |
| 4.) | 5,02 g | 1,368 | 1,383 | 1,392 | 1,394 | 1261,2 | blaue Lsg. |
| 5.) | 5,00 g | - | - | - | - | - | * |
| 6.) | 4,99 g | - | - | - | - | - | * |
* farblose Lösung - keine Extinktion, da störende Stoffe die Farbreaktion beeinflussten (wir bekamen negative Extinktionswerte)
Rechenbeispiel:
![]()
![]()
Ergebnis:
Bei den Düngern, Tannendünger und den Düngestäbchen, kam es zu keiner reproduzierbaren Extinktion der Farbreaktion, da Störungen der Farbreaktion vorlagen. Es kam zu einer sehr intensiven Blaufärbung der Lösung. Die erhaltenen Extinktionswerte lassen uns darauf schließen, dass die Lösungen zu konzentriert waren und daher bei diesen Extinktionen das Lambert - Beersches Gesetz nicht mehr gilt. Weiterhin sind Störungen im Extrakt gewesen, da es zu einer sofortigen Farbreaktion der Reagenzien kam. (Nach Zugabe von Ammoniummolybdat-Lösung kam es zu einer flockigen starken Gelbfärbung.)
Im Vergleich auf die Angaben des Herstellers auf den Gesamtphosphatgehalt liegen unsere Werte unter diesen Angaben.
7.2.3 Säure- Base- Titration
Der pH- Wert der Düngemittel lag im neutralen Bereich.
Aufgabenstellung
Eine bestimmte Masse (ca. 1g) Boden werden in Wasser gelöst und mit einem Magnetrührer gut durchmengt. Anschließend wird die Lösung vorsichtig abdekantiert und mit 2-3 Tropfen Methylorange versetzt und mit einer eingestellten Salzsäure (c~ O,1 mol/l, t= 1,2182) von gelb nach orange bis pH 4,3 titriert.
Auswertung der Säurekapazität Ks +m-Wert (pH 4,3)
Reaktionsgleichung
| HCO3- + HCl | → | H2O + CO2 + Cl- |
| CO32- + 2 HCl | → | H2O + CO2 + 2Cl- |
| OH- + HCl | → | H2O + Cl- |
Definition
Gibt die Aufnahmekapazität von Salzsäure an, bis zu einem pH- Wert von 4,3. (+m -Wert)
| Art | Einwaage in g | Verbrauch an HCl, c ~ 0,1 mol / L, t = 1,2182 | Auf 1 g Dünger |
| 1. | 1,0745 | 5,15 ml | 4,79 ml |
| 2. | 1,0720 | 4,73 ml | 4,41 ml |
| 3 | 1,0070 | 1,71 ml | 1,70 ml |
| 4 | 1,0840 | 6,97 ml | 6,43 ml |
| 5 | 1,0112 | 3,84 ml | 3,80 ml |
Säure / Base -Titration mit dem Magnetrührer
Ergebnis:
Die Säurekapazität konnte ermittelt werden. Es lässt sich dennoch nicht im Verhältnis 1 zu 1auf Hydrogencarbonat zurückschließen, da alkalisch reagierende Salze auch die Salzsäure umsetzen.
7.2.4 Schnelltests von Aquanal - Ökotest (Halbquantitative Ammoniumbestimmung) Kolorimetrisches Verfahren
Durchführung
Zur Probenvorbereitung wurden ca. 10 g Dünger eingewogen und mit 100 ml Wasser extrahiert.
Wir haben 5 ml Extrakt mit der Reagenzlösung 1 versetzt. Anschließend haben wir das Teststäbchen in die Lösung gehalten und nach 5 min einen Farbabgleich mit der Farbkarte gemacht. Damit konnten wir die ungefähre Ammonium Konzentration der einzelnen Düngemittel bestimmen.
Auswertung:
10 g Düngemittel wurden in 100 ml Wasser extrahiert, dabei wurden folgende Konzentrationen abgelesen.
Ammoniumgehalt in mg/l:
- (Tannendünger) 10 mg/l
- (Beerendünger) 0,05 mg/l
- (Rosendünger) 0,05-0,2 mg/l
- (Tomatendünger) 10 mg/l
- (Düngestäbchen) 0,2 mg/l
Die Konzentrationen wurden nur halbquantitativ bestimmt und haben deshalb keine relevante Aussagekraft. Die Bestimmung dient nur als Näherungsangabe des Ammoniumgehaltes. Der Tannendünger und der Tomatendünger heben sich deutlich von den anderen ab. Im Vergleich zu den Herstellerangaben, haben diese zwei Dünger auch den meisten Stickstoffanteil als die anderen Dünger. Es wurden aber nur die Ammoniumverbindungen gemessen, die sich im Wasser lösen und daher ist der Vergleich zum Gesamtstickstoffgehalt nicht gegeben. Die Düngerstäbchen jedoch haben einen größeren Stickstoffgehalt laut Hersteller als bei diesem Test gemessen. Der Grund sind wieder die Löslichkeiten der Ammoniumverbindungen. Die anderen Verbindungen des Stickstoffs wie Nitrate lassen sich hier nicht erfassen.
7.2.5 Bestimmung von Gesamt- Stickstoff
(Kjeldahl - Methode)
Geräte:
Kjeldahl - Aufschlusskolben
Destillationsapparatur
Reagenzien:
Kupfer (als Späne oder Pulver) oder Kupfersulfatpentahydrat pulverisiert
Schwefelsäure, r = 1,84 g/ml
Zink, geraspelt, stickstofffrei
Schwefelsäure - Maßlösung, c(1/2 H2SO4) = 0,5 mol /L
Natronlauge, b = 400 g/L
Natronlauge -Maßlösung, c = 0,25 mol/L
Indikatorlösung nach TASHIRO
Durchführung
1 g der Probe auf 0,001 g genau einwiegen und in einem Kjeldahl - Aufschlusskolben nach Zugabe von etwas Kupfer mit 20 bis 30 ml Schwefelsäure (r = 1,84 g/ml) vorsichtig übergießen. Nach Beendigung einer mit Schäumen verbundenen Reaktion mit kleiner, später mit größerer Flamme erhitzen bis die Flüssigkeit völlig klar geworden ist und eine hellgrüne Färbung zeigt. Es empfiehlt sich, nach dem Klarwerden noch etwa 60 min weiter zu erhitzen.
Nach dem vollständigen Abkühlen des Kobens der Aufschlussflüssigkeit vorsichtig nach und nach 250 ml Wasser zusetzen. Die sich hierbei erwärmende Lösung wieder abkühlen lassen.
Den Aufschlusskoben ggf. wenn verwendbar für die Destillation benutzen oder quantitativ in geeigneten Kolben über spülen. Dann gibt man den Zink in den Destillationskolben.
Als Vorlage für die Absorption des bei der Destillation übergehenden Ammoniaks einen ausreichenden, gemessenen Überschuss an Schwefelsäure- Maßlösung in den Vorlagekolben geben.
In den Tropftrichter gibt man 90 ml Natronlauge (bzw. 120 ml bei 30 ml H2SO4) und mit dem Erhitzen beginnen. Man destilliert ungefähr 30 bis 40 min. Der Überschuss an Schwefelsäure - Maßlösung wird mit einigen Tropfen des Indikator mit der Natronlauge - Maßlösung zurücktitriert.
Blindwerttest: Die gleiche Weise mit den gleichen Reagenzien werden durchgeführt, aber ohne Probe.
Auswertung:
Stickstoffgehalt in g/100g :
![]()
V1 = Volumen (ml) der Schwefelsäure - Maßlösung
V2 = Volumen (ml) der Natronlauge - Maßlösung
V3= Volumen (ml) der Schwefelsäure - Maßlösung für den Blindwerttest
V4 = Volumen (ml) der Natronlauge - Maßlösung für den Blindwerttest
m = Masse (g) der eingesetzten Probenmenge
| Art | m (Dünger) | V1 (H2SO4) | V2 (NaOH) | Stickstoffgehalt in g / 100 g |
| 1. | 1,0899 g | 31,23 ml | 40,88 ml | 6,9 |
| 2. | 1,0230 g | 62,46 ml | 111,80 ml | 4,5 |
| 3. | 1,0352 g | 41,64 ml | 70,61 ml | 4,3 |
| 4. | 1,0234 g | 52,05 ml | 76,49 ml | 9,4 |
| 5./6. | 1,0000 g | 52,05 ml | 74,86 ml | 10,2 |
(V3/V4 waren 0)
Ergebnis:
Die Düngestäbchen (5./6.) und der Tomatendünger (4.) haben einen besonders hohen Gesamtstickstoffanteil von ca. 10 g /100g im Vergleich zu den anderen Düngern.
7.2.6 Andere Versuche den Guano analytisch zu bestimmen
Harnstoffspaltung mittels Urease
Reaktionsgleichung:
H4N2CO + H2O (Urease) → 2 NH3 + CO2
Nachweisreaktionen von Stickstoffverbindungen im Düngemittel:
Unsere Idee war die Spaltung von Harnstoff mit dem Enzym Urease in Ammoniak und Kohlenstoffdioxid. Der Guano ist ein organischer Dünger und enthält Exkremente von Tieren, daher war unsere Idee Stickstoff über die Spaltung von Harnstoff zu bestimmen.
Durchführung:
100,6 mg Harnstoff werden mit einer neutralen Formalinlösung (15 ml) versetzt und mit einer Spatelspitze Urease (1Unit Urease spaltet 1 µmol NH3 pro Minute). Dabei wollten wir durch Rücktitration von einer 0,1 molaren Natronlauge die entstandenen Protonen mit dem Indikator Phenolphthalein titrieren.
Der Verbrauch war nicht Aussagefähig, da zu niedriger Verbrauch aufgrund einer zu konzentrierten Natronlauge.
Bei einer 0,01 molaren Natronlauge erfolgte das gleiche Ergebnis, Einwaage von Harnstoff 102,0 mg, Verbrauch 0,3 ml Natronlauge.
Daraufhin schlossen wir, dass das Volumen der Formalin - Lösung nicht ausreichte, deshalb haben wir unsere Lösung mit 60 ml Formalin - Lösung versetzt. Diesmal entstand eine sofortige Rosafärbung des Indikators. Möglicherweise funktionierte die Urease nicht. Mit der Einwaage von entsprechend viel Düngemittel erbrachte auch die gleichen Ergebnisse. Der Harnstoff sollte nur als Vorprobe dienen.
Danach versuchten wir über eine Kjeldahl Bestimmung den entstandenen Ammoniak zu bestimmen. Unser Ansatz war, dass aus 1 mol Harnstoff 2 mol Ammoniak entstehen, die wiederum 2 mol Salzsäure (c~0,1 mol/ l t = 1,2075) verbrauchen.
Wir wogen 85,6 mg Harnstoff in ein Kolben ein und ließen es mit demin. Wasser und Urease bei einer Temperatur von 30°C erwärmen (½ Stunde).
Nun destillierten wir den Ammoniak in die Salzsäure - Vorlage. Die Vorlage wurde dann mit einer 0,1 molaren Natronlauge t= 0,9735 titriert.
(HCl -Vorlage = 60,38 ml, Verbrauch an Natronlauge 55,02 ml, d.h. die errechneten ca. 48,5 mg entstandenen Ammoniaks wurden nicht erreicht.)
Ergebnis:
Der Versuch mit einem Enzym den Harnstoff zu spalten schlug fehl, aufgrund von Enzymhemmung, die durch Störungen hervorgerufen wird.
| 8. Fazit und Problemstellung | zum Seitenanfang  |
Unsere Aufgabenstellung ist die Prüfung eines Guano - Düngers nach dem Rezept von Stöckhardt. Wir sind diesem Rezept nachgegangen und haben den Trockenverlust, Glühverlust, die Reaktion mit Kalk und mit Essig bestimmt. Demnach konnten wir eine relativ - quantitative Aussage über den beim Verbrennen entstandenen Ammoniak machen. Stöckhardt formuliert hierzu je mehr Ammoniak entsteht und je weniger Horngeruch, desto besser ist der Dünger. Wir haben jedoch festgestellt, dass man in heutigen Produkten extra Hornmehl o.ä. zugibt, um bessere Resultate der Pflanzen zu erreichen. Ein weiterer Nachweis vom Anteil des Stickstoffs macht Stöckhardt mit Wasser und gelöschtem Kalk, dass auch nur relativ nach heutigen Messverfahren zu beurteilen ist. Stöckhardt wollte den normalen Menschen eine Meßmethode näher bringen, wie man schnell einen konzentrierten Düngemittel zum Analysieren kann. Da früher ein Großteil der Bevölkerung auf eine gute Ernte angewiesen war. Die Reaktion mit Essig und Dünger konnte man ohne größeren Aufwand schnell umsetzen, um den Kalkgehalt festzustellen.
Um genauere Anteile von den Hauptnährstoffen einer Pflanze zu bekommen haben wir neuere Analysenmethoden angewandt. Wir haben den Gesamtkaliumgehalt flammenphotometrisch bestimmt. Ein Problem stellte sich anfangs dar die Konzentration des Kaliumsextraktes zu bestimmen. Aber durch eine geeignete Verdünnung konnte man dieses Problem rasch beheben. Jedoch der Flüssigdünger ließ sich in keiner geeigneten Konzentration messen, da der Messfehler insgesamt zu groß war. Die Bestimmung des Phosphatgehaltes konnten wir nur bei 3 ausgewählten Sorten relativ genau bestimmen (der Rosen-, Beeren- und Tomatendünger). Wahrscheinlich lagen zu viele Störungen im Dünger vor, die die einzelnen Reaktionen mit den Reagenzlösungen beeinflussten. Ein größeres Problem stellte uns jedoch die Bestimmung des Stickstoffs dar. Wir hatten einige Ansätze bestimmte Stickstoffverbindungen zu analysieren, aber es gab einige Störreaktionen. Einige von uns gefundene Vorschriften besagten schon im Voraus, dass bspw. eine Bestimmung des Ammoniums über Kjeldahl die Anwesenheit von Eiweißen, Cyanamide und Harnstoffverbindungen störend wirken. Eine andere Methode den Gesamtstickstoff mittels Verbrennungsmethode zu bestimmen scheiterte an der Umsetzung und das Fehlen von den Geräten wie einer Mikrowaage und einem Stickstoffanalysators. Eine ausgeführte Methode war das Schnelltestverfahren. Diese Ergebnisse gaben uns einen ungefähren Leitwert nur an. Das Bestimmen von Harnstoff im Düngemittel wurde für uns schon in der Vorprobe des Blindwertes (reiner Harnstoff) kaum lösbar. Die Fehler lagen wahrscheinlich in der Reaktionsweise der Urease mit dem Harnstoff. Darauf schlossen wir, dass die Urease gehemmt war. Der Gesamtstickstoff wurde mit einem Aufschluss und mit der Kjeldahl - Methode bestimmt. Die Resultate waren besonders hoch bei den Düngestäbchen und bei dem Tomatendünger. Jedoch lagen sie unter der Verpackungsangaben.
Mit der Säure / Base Titration wollten wir die Säurenkapazität (+ m-Wert; KS 4,3) des Düngers untersuchen. Wir titrierten den Dünger, der in Wasser gelöst war mit einer eingestellten 0,1 molaren Salzsäure. Problematisch jedoch war die Erkennung des Farbumschlages von Methylrot, trotz Absetzen der Suspension. Wir variierten daraufhin die Einwaagen des Düngers und kamen auf einen optimalen Massenwert von ca. 1g Dünger.
Die untersuchten sechs Düngemittel, die Guano enthalten, waren im Großteil sehr ähnlich in ihrer Zusammensetzung aufgebaut. Sie unterschieden sich nur in einigen Bereichen, da sie für verschiedene Pflanzenarten abgestimmt sind. Die Düngestäbchen für Grünpflanzen und Tomaten haben den gleichen Bestandteile, werden jedoch unter unterschiedliche Verpackungen und Beschriftung vertrieben. Deshalb haben wir bei einigen Bestimmungen, diese Düngestäbchen zusammen bestimmt.
Schlussfolgerung unserer Projektarbeit
Das Thema für unsere Projektarbeit war für uns ein neues interessantes Themengebiet. Erst einmal haben wir uns mit dem Begriff Guano auseinandergesetzt, da er für uns noch kein Begriff war. Bereits schon in den Sommerferien 2002 haben wir über Internetsuchmaschinen alles über Guano und Düngemittel gesammelt, sogar haben wir Handelsfirmen und Umweltministerien angeschrieben. Aber wir haben wenig Information über Guano erhalten, da die Firmen nur den Dünger vertrieben hatten. Die Umweltministerien haben uns auch nur teilweise mit Informationsmaterial versorgt. Einfacher fiel uns das Rezept nach Stöckhardt umzusetzen. Die neueren Methoden wie Stickstoff zu bestimmen wurde für uns fast unlösbar. Da im Guano- Dünger viel störende und hemmende Stoffe drin sind, konnten wir einige Vorschriften für die Bestimmung der Düngemittel nicht bzw. nur unbefriedigend durchführen. Ganz in allem lehrte uns die Projektarbeit mit einem ganz bestimmten Bereich sich intensiv zu beschäftigen. Aber auch Probleme zu beseitigen und Arbeitsvorschriften neu abzustimmen. Ein weiterer wichtiger Aspekt war für uns die Zusammenarbeit im Team gemeinsam die Projektarbeit zu lösen.
| 9. Zusammenfassung zu unserer Projektarbeit | zum Seitenanfang  |
"Prüfung eines Guano- Düngers"
Guano ist ein organischer Dünger, dass aus Exkrementen von Vögeln stammt, vor allem von Seevögeln, aber auch von Fledermäusen. Es kommt in größeren Mengen auf Inseln und Küstenabschnitten besonders in Peru (Peru- Guano) vor.
Die Projektarbeit ist in einem historischen und heutigen Abschnitt aufgegliedert. Der erste Teil handelt von dem Nachweis eines Guano - Düngers im 19. Jahrhundert von Stöckhardt. Dazu gehören die Untersuchungen des Trockenverlustes, Glühverlustes, der Kalkprobe und das Übergießen der Probe mit Essig. Die heutigen Versuchsmethoden bestimmten wir die drei wichtigsten Hauptnährstoffe eines Guano - Düngers. Dazu untersuchten wir den Gesamtstickstoff, den Kalium - und Phosphatgehalt.
Der Gesamtstickstoff wurde erst mit konzentrierte Schwefelsäure und einen Katalysator (Kupfersulfatpentahydrat) in einer Rückflussapparatur aufgeschlossen. Anschließend wurde der Stickstoff über Kjeldahl bestimmt.
Die Kaliumverbindungen haben wir mit CAL - Lösung extrahiert und mit Hilfe eines Flammenphotometers gemessen.
Der Phosphatgehalt erfolgte über die "Phosphormolybdänblau" - Methode unter Verwendung eines Photometers (l = 720 nm).
| 10. Summary | zum Seitenanfang  |
Our project deals with an organic fertilizer called guano. It comes from the Inka language and means dung. It consists of excrements e. g. birds, bats, seals. In the mid- 1800s guano was a very important trade product between Europe and Latinamerica.
The task was to proof the guano- fertilizer on the basis of a recept from Stöckhardt. The recept tells us how you can find out, if the fertilizer is a good once or not. We analysed the dry weight of guano by a temperature from 105°C and 550°C. We burned the fertilizer over a Bunsen burner.
The ammonia amount was proofed after this method and with the mixture of water and lime. A foam was developed with the addition of acetic acid to the guano. We used also new methods to analyse the three main components in the guano: nitrogen, phosphate and potassium. Nitrogen could we find with the Kjeldahl process. We determined the phosphat part with the PMB method and are measured by a photometer (720nm). The last compound is the potassium concentration that we read from a calibration curve with the flame photometer.
The 6 fertilizer that we analysed, had similary results. So we could conclude guano is a very rich fertilizer at nitrogen, phosohate and potassium than others. Nowadays the guano is mixed with mineral fertilizer and had a wide application field e.g. tomatos, flowers and fir trees.
| 11. Quellennachweis | zum Seitenanfang  |
Literatur
- "Pflanzliche Erzeugung" von BLV Verlagsgesellschaft München
- Broschüre und Wissenschaftliche Auszüge von Analysen von Compo - GmbH Münster
- "Grundstufe Agrarwirtschaft" von BLV Verlagsgesellschaft München
- "Chemie - Schüler - Duden" Duden
- "Methodenbuch Band 1 & 2 -Die Untersuchungen von Düngemitteln" VDL UFA- Verlag Darmstadt
- "Pflanzenernährung und Düngung" UTB für Wissenschaft Ulmer von Günther Schilling
- "Anwendung des Guano als Dünger" Elberfeld, gedruckt bei Julius Schellhoff, 1845
- History of the Guano Mining Industry; Journal of Cave and Karst Studies, 1998
- "Handbuch der Pflanzenernährung und Düngung" Springer Verlag 1968
- Chemie Sek 2 Physikalische Chemie und Umwelt von Volk und Wissen
Internetquellen (Stand Mai 2003)
- http://mindepos.bg.tu-berlin.de/lager/wipki/guano.htm
- http://www.biplantol.de/Produkte/Guano/guano.html
- http://www.zg-raiffeisen.de/download/Erdbeerduenger.pdf
- http://www.philguano.com/Was%20ist%20guano.htm
- http://www.mnd.fh-wiesbaden.de/fag/gblb/zb/zbnews.html
- http://mindepos.bg.tu-berlin.de/lager/wipki/inhalt.htm
- http://www.uni-giessen.de/~gi04/ch_briefe/vorrede4.htm
- http://www.xipolis.net
- http://www.duenger-shop.de
- http://www.umweltministerium.bayern.de/service/lexikon/d.htm#duengemittel
- http://www.brandenburg.de/land/mlur/pflanze/wachstum.htm
- http://www.michaels-tomaten.de/naehrs.htm
- http://www.compo.de
- http://www.nordland-guano.de
- http://www.tu-dresden.de
- http://www.fu-berlin.de
- http://www.bayer.de
- http://www.basf.de
- http://www.imarpe.gob.pe/aves/Guano.html
- http://www.drd.de/helmich/bio/stw/enz/vers/versuch03.html
- http://www.frux.de
- http://dc2.uni-bielefeld.de/dc2/tip/06_00.htm
- http://home.t-online.de/G.Koehl/hpglossa.htm
- http://www.naturduenger.de
- http://www.mr-evergreen.de
Anfragen per Brief oder e-Mail
- LUFA, Karlsruhe (Augustenberg; 430230)
- Regierungspräsidium Stuttgart; Abt.3 Landwirtschaft (Ruppmannstr.21)
- ALLB Pforzheim (Agrar-Landwirtschaftlicher Betrieb)
- IVA unter E-Mail iva.de
- Broschüre von Brill Substrate und Guano Dünger aus www.brill-substrate.com und Gebr. Brill Substrate GmbH & Co. KG aus Georgsdorf
- E-Mail an Dr. Ruediger Rexilius von substrate-ev.org
- Floragard Vertriebs GmbH für Gartenbau in Oldenburg
- HAWITA Gruppe GmbH
- Labroco Agrarconsult & Vertriebs GmbH
Andere Informationsbeschaffungen:
- Prof. Dr. Schwedt
- Unibibliothek Hohenheim (Bibliothekarin)
- Frau Pfiz
- Herr Ruf
- Toom Baumarkt in Elsterwerda mit Gartenbaufachpersonal
- Mitschüler (Stefan Neubert, der sich in der Landwirtschaft gut auskennt)
- Raiffeisenmarkt, Mühlacker
- Stinnesbaumarkt
- Buchhandlung, aber es gibt kein gefundenes Buch mit dem Titel Guano-Dünger
- Verwandte, die in der Agrarwissenschaft tätig sind (M. Katzban)
| 12. Anhang | zum Seitenanfang  |
Verpackungen der Guano- Düngemittel
Tannen- und Koniferendünger von floraplus
|
Beerendünger von floraplus
|
Rosendünger von Gärtner's
|
Tomatendünger von Compo
|
Düngerstäbchen für Tomaten und Grünpflanzen von Compo
|
|
« zurück zur Übersicht - Projektarbeiten






