« zurück zur Übersicht - Projektarbeiten
"Schulversuche in der Mikrowelle"
von Alexander Tsapanidis und Lukas Gross (Schuljahr 2007/08)
| Vorwort | zum Seitenanfang  |
Diese Projektarbeit wurde unter Betreuung von Herrn Prof. Dr. P. Menzel, Professor für Didaktik der Chemie und Ökologie an der Universität Hohenheim, in der Zeit von September 2007 bis Januar 2008 durchgeführt.
Unser besonderer Dank gilt Herrn Prof. Dr. P. Menzel für die engagierte Unterstützung und für die Ermöglichung der Teilnahme am Fehling-Lab in der Universität Stuttgart am 14. Dezember 2007. Dieser Besuch brachte uns für die Projektarbeit weiter.
Ebenso danken wir Herrn Flad für Ideen und für die Bereitstellung von Informationsmaterialien, mit denen wir die Versuche durchgeführt haben.
Danken möchten wir auch Herrn Ruf, der uns immer mit Tipps zur Seite stand, wenn Schwierigkeiten aufkamen. Durch ihm bekamen wir jederzeit Werkzeuge, die wir für die Versuche brauchten.
Auch Frau Pfiz wollen wir danken. Sie stand uns stets zur Seite mit Ideen und Tipps.
Herrn Tassilo Kaule vom Fehling-Lab danken wir für den interessanten und hilfreichen Nachmittag am 14. Dezember 2007. Er versorgte uns mit Porzellantiegel und Informationsmaterial.
| 1. Einleitung [1] | zum Seitenanfang  |
Die Mikrowelle (Mikrowellenherd) ist ein sehr nützliches Gerät zum Aufwärmen von Speisen, Flüssigkeiten und anderen geeigneten Stoffen mit Hilfe der Absorption von Mikrowellen. Auch ist sie in vielen Gebieten wie z.B. in Synthesevorgängen oder Destillationen einsetzbar. Zum Teil ist die Mikrowelle, wie sie in Haushalten benutzt wird für solche Zwecke einsetzbar. In der Industrie werden andere Mikrowellenherde, die sich preislich und in ihrer Funktion drastisch von Haushaltsmikrowellenherde unterscheiden eingesetzt. Der Aufbau eines Mikrowellenherdes sieht im Grundaufbau immer gleich aus.
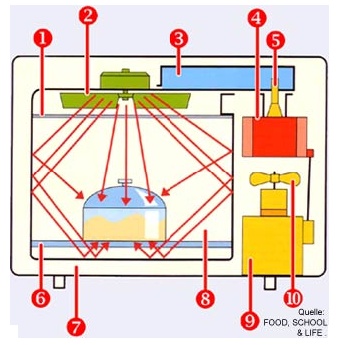
Abb. 1 Mikrowellenofen
(1) Deckplatte, (2) Reflektorflügel, (3) Hohlleiter, (4) Magnetron, (5) Koppelstift, (6) Bodenplatte, (7) Gehäuse, (8) Garraum, (9) Elektronik, (10) Kühlgebläse
Die Mikrowellen werden durch ein Magnetron erzeugt und über einen Hohlleiter in den Garraum des Mikrowellenherdes geleitet. Der Raum ist so konstruiert, dass die Mikrowellen nicht die Möglichkeit haben, nach Außen durchzudringen, somit besteht keine Gefahr für den Verbraucher. Das Magnetron benötigt für seine Anwendung eine exorbitante Anodenspannung von 5 kV (5000V), diese wird durch einen Hochspannungstransformator und einer Spannungsverdopplungsschaltung erzeugt. Die Hochspannung besteht aus einem pulsierenden Gleichstrom.
Wie das Magnetron wird auch dessen Glühkathode von dem Hochspannungstransformator mit Strom versorgt. Durch diese Versorgung entsteht Wärme, die mittels eines Ventilators in den Garraum geleitet wird.
Natürlich hat jeder Mikrowellenherd eine Tür, die sehr wichtig für die Sicherheit des Verbrauchers ist. Durch den Verschlussmechanismus der Türe des Mikrowellenherdes wird bei der Benutzung verhindert, dass beim Öffnen der Türe schädliche Mikrowellen nach Außen dringen, da sich das Gerät automatisch abschaltet. Zusätzlich gewährt die Tür durch ein Lochblech Einblick in den Garraum. Das Lochblech verfügt über Öffnungen, deren Abstand weitaus geringer ist als eine halbe Wellenlänge der Mikrowelle, das erklärt auch, warum die Mikrowellen nicht austreten können. Zur vollständigen Strahlenauslöschung hat die Mikrowelle wenige Millimeter vor dem Lochblech eine Scheibe, die verhindert, das die Strahlung der Mikrowellen direkt auf das Lochblech trifft.
Zum Wirkungsgrad lässt sich folgendes sagen:
Im Gegensatz zum Elektroherd der ca. 100 % der elektrischen Energie in Wärme umwandelt, verwandelt der Mikrowellenherd nur 50-60 %. Jedoch heizt der Mikrowellenherd gezielt die zu erwärmende Speise, da die Mikrowellen direkt in diese eindringen und nicht, wie beim Elektroherd zuerst den Herd bzw. Umgebung aufheizen. Bei kleineren Mengen zum Erwärmen von Speisen ist daher der Mikrowellenherd ökonomisch günstiger.
| 2. Definitionen zur Mikrowelle [2] | zum Seitenanfang  |
Magnetron:

Abb. 2 Magnetron
Magnetrone sind Vakuumröhren und bestehen aus einer Kathode, Hohlraumresonatoren und einer Anode. Magnetrone werden in der Mikrowelle als ein elektronisches Bauelement benutzt, wobei die Kathode ringförmig von einem Anodenblock umgeben ist.
Die Kathode hat in gleichmäßigen Winkelabständen eingefräßte Schlitze und Bohrungen. Die Anode und Kathode sind von einem Permanentmagneten umschlossen. Aus der Kathode treten Elektronen aus, die durch das permanente Magnetfeld in kreisförmigen Umlaufbahnen um die Kathode gelenkt werden. Durch einen Aussortierungsvorgang werden die elektromagnetischen Wellen, die an der Anode vorbei kommen, verstärkt. Durch die elektromagnetischen Wellen werden die Elektronen gebremst, wobei diese die Anode berrühren. Jedoch gibt es auch Elekronen, die durch die Wellen beschleunigt werden. Diese werden durch das Magnetfeld auf die Oberfläche der Kathode zurückgelenkt. Die Auskopplung der Mikrowellenschwingung erfolgt über Hohlleiter und Antennen. In Haushaltsmikrowellen sind Magnetrone vorhanden, die eine Frequenz von 2,45 GHz und einen Wirkungsgrad von 70 % haben. Der Nachteil dieser Magnetronen ist dessen kurze Lebensdauer von ca. 5.000 Stunden.
| 3. Ein Blick in die Geschichte der Mikrowelle [3] | zum Seitenanfang  |
Schon vor dem Jahr 1939 versuchten Wissenschaftler für das Militär Mikrowellen zu erzeugen. Aber erst im Jahre 1939 gelang den englischen Wissenschaftlern John Randall und Harry Boot, die Komponenten (das Magnetron) zur Mikrowellenerzeugung herzustellen. Zu diesem Zeitpunkt konnte noch keiner wissen, welche Bedeutung dies für die Menschheit hat und wie schnell sich die Weiterentwicklung fortsetzen würde. Bis zu diesem Zeitpunkt wurden Mikrowellen nur für militärische Zwecke eingesetzt. Das Magnetron wurde für den Bau kurzwelliger Radargeräte genutzt. Nur zwei Jahre später wurden die kurzwelligen Radargeräte von der Royal Air Force in Flugzeuge eingebaut. Das Magnetron wurde zu einem wichtigen Kriegsgeheimnis der Engländer.
Einige Jahre später wurde die amerikanische Firma Raython mit in die Forschung einbezogen. Bei dieser Firma bekam der Ingenieur Percy L. Spencer den Auftrag die Magnetröhren zu verbessern. Da es ihm gelang wurde er zu dessen wichtigsten Hersteller. Im Jahre 1945 fand Percy Spencer heraus, dass Speisen mit Mikrowellenstrahlung erwärmt werden können. Es war eine klassische Zufallsentdeckung. Bei seiner Arbeit mit Mikrowellen schmolz in seiner Tasche ein Schokoriegel. Dies brachte ihn auf die Idee, Lebensmittel mit Hilfe von Mikrowellen zu erhitzen. Schon zwei Jahre später gab es den ersten Mikrowellenherd für 2000 Dollar. Dieser war jedoch viel zu teuer und wurde deshalb kaum verkauft.
Erst Mitte der 60er Jahre kamen billigere Mikrowellenherde auf den Markt. Sie kosteten weniger als 500 Dollar. Nun begann der Siegeszug des Mikrowellenherdes in der Küche. Im Labor konnte die Mikrowellentechnik erst Ende der 90er Jahre ihren Durchbruch erlangen. Trotz vielfältiger neuer Möglichkeiten, insbesondere in der organischen Synthese, liefen die technische Entwicklung von auf den Laborbedarf zugeschnittenen Mikrowellen erst langsam an. Jedoch sind heute immer mehr Labormikrowellenherde erhältlich.
Durch die kontinuierliche Preissenkung dieser Geräte, wird es vermutlich nicht mehr lang dauern, dass sich die Mikrowellentechnik gegen die konventionellen Heizplatten durchsetzt.
| 4. Vorbereitungen für die Schulversuche | zum Seitenanfang  |
Herstellung des GST-Elementes (die Graphit-Suszeptor-Tiegel-Technik)
Suszeptor = Sammler
Materialien
Graphitspray, Ofenmörtel (muss bis 1200 Grad Celsius beständig sein), Porzellantiegel (20 ml, mittelhohe Form), Blumentopf aus Ton (100 ml), Luftballon, Spatel, Trockenschrank.
Durchführung [4]
Zunächst wird der Ofenmörtel so lange mit Wasser vermengt, bis die richtige Konsistenz (eine dickflüssige Masse) erreicht ist. Ist dies erreicht, wird die angerührte Masse in einen Tonblumentopf gefüllt. Danach wird ein Porzellantiegel, welcher zuvor in eine Luftballonhülle gedrückt wurde, in die Masse hineingedrückt. Es sollten nur noch die oberen 0,5 cm des Tiegels sichtbar sein. Mit einem Spatel wird die überstehende Mörtelmasse glatt gestrichen. Zusätzlich benützt man den Spatel dazu, um eine kleine Einkerbung neben dem Porzellantiegel in den Mörtel zu drücken. Dies hat den Vorteil, dass bei der späteren Verwendung des GST-Elementes, der Porzellantiegel mittels einer Tiegelzange leichter aus der Form geholt werden kann. Nachfolgend wird der Blumentopf mit dem Porzellantiegel in den Trockenschrank gegeben und der Mörtel bei 80 - 90 °C mehrere Stunden getrocknet (am besten über Nacht). Nachdem das GST-Element trocken ist, wird der Tiegel mit dem Luftballon aus der Form gezogen und von der Luftballonhülle befreit. Anschließend wird die Mörteloberfläche der Tiegelhöhlung mehrmals mit Graphit besprüht.
Es wurde auch ein AST-Element hergestellt, wobei kein Graphitspray, sondern Aktivkohle (grobe Körnung) verwendet wurde. Mit diesem AST-Element (Aktivkohle-Suszeptor-Tiegel-Technik) wurden auch Versuche durchgeführt, um zu schauen, ob die unten genannten Versuche damit auch dasselbe Ergebnis erbringen. Wir stellten fest, dass es keine Unterschiede gibt, ob man ein GST- oder ein AST- Element benutzt.
Hinweis:
Zur Durchführung von allen Versuchen wird das GST-Element auf einen Gasbetonstein in den Mikrowellenherd ohne Drehteller in einen Bereich hoher Strahlungsintensität gestellt.
Hot-Spot-Ermittlung
Um den Bereich mit der höchsten Strahlungsintensität zu ermitteln, muss zuerst der Hot-Spot ermittelt werden. Man nennt diesen Bereich auch den Punkt der Mikrowelle, an der die höchste Temperaturentwicklung möglich ist.
Geräte und Materialien
Haushaltsmikrowellenherd (800 Watt), Papiertücher, Thermo-Faxpapier, Keramikplatte, Tesafilm oder Klebeband.
Durchführung
Auf der Keramikplatte wird ein Papiertuch befestigt, welches mit Wasser angefeuchtet wird. Auf das Papiertuch wird das Thermo-Faxpapier glatt aufgetragen und in den Haushaltsmikrowellenherd hineingestellt. Dabei ist zu beachten, dass der Drehteller aus der Mikrowelle genommen wird. Die Türe wird geschlossen und bei maximaler Leistung so lange eingeschaltet, bis sich eine Schwärzung auf dem Thermo-Faxpapier abzeichnet.
 |
 |
| Abb. 4 Keramikplatte mit Papiertuch | Abb.5 Keramikplatte mit Papiertuch und Thermo-Faxpapier |
Beobachtung und Auswertung
Schon nach einigen Sekunden sieht man an einer Stelle die erste Schwarzfärbung. Die Versuchsdurchführung kann dann sofort beendet werden. Die Schwarzfärbung zeigt, wo die Strahlungsintensität am größten ist und somit dort der Hot-Spot liegt. Das feuchte Papiertuch wird an diesem Punkt schneller erhitzt, dadurch verdampft das Wasser an dieser Stelle früher. Die hohe Temperatur verursacht die Schwärzung des Thermo-Faxpapiers.
Nun sind alle Vorbereitungen abgeschlossen.
| 5. Schulversuche - Hochtemperaturversuche | zum Seitenanfang  |
Im folgenden werden die verschiedenen Schulversuche vorgestellt. Die Versuche wurden insoweit optimiert, dass sie mit weniger Chemikalien bzw. weniger Leistung (Watt) oder in kürzerer Zeit durchgeführt werden können. Dabei wurde beachtet, Chemikalien zu benutzten, die nicht gefährlich und nicht zu teuer sind.
Alle Versuche wurden zusammen durchgeführt und bearbeitet.
| 5-1. Darstellung von Gelbmessing | zum Seitenanfang  |
Messing ist eine Legierung, die aus Kupfer und Zink besteht. Da Kupfer und Zink nicht gesundheitlichschädlich sind, kann man diesen Schulversuch ohne Probleme und Sicherheitsvorkehrungen durchführen. Messing ist schon seit dem dritten Jahrtausend v. Ch. bekannt. Seitdem werden hauptsächlich daraus Schmuck und Kunstgegenstände hergestellt. Ebenso werden viele Blechinstrumente aus Messing hergestellt.
| Ziel des Versuchs | Die Herstellung von Gelbmessing aus Kupfer und Zink |
| Geräte und Chemikalien | GST-Element, Gasbetonstein, Haushaltsmikrowellenofen (800 Watt), Tiegelzange, Spatel, Hammer, Amboss, Kupfer (Cu) (feines Pulver), Zink (Zn) (feines Pulver). |
| R- und S-Sätze |
|
| Gefahrensymbole |
|
| Durchführung [4] |
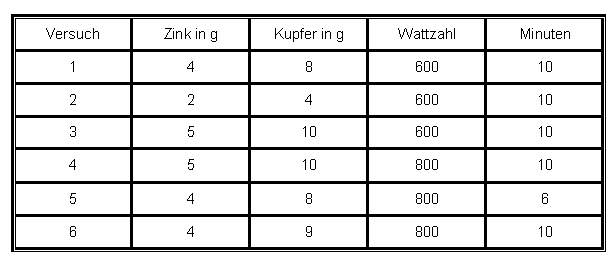
Im Porzellantiegel des GST-Elements wird 8 g Kupferpulver (Cu) mit 2 g Zinkpulver (Zn) sorgfältig vermischt. Anschließend wird der Porzellantiegel wieder in das GST-Element gestellt. Das GST-Element befindet sich auf dem Gasbetonstein, der sich auf dem Hot-Spot befindet. Nun wird der Tiegel mit einem Porzellandeckel abgedeckt und bei 600 Watt 5 Minuten erhitzt. Es ist zu beachten, dass der Tiegel abgedeckt wird, da sich viel Zinkoxid-Rauch bildet. |
| Beobachtung |
Nach dem Erhitzen hat sich keine Legierung gebildet. Mit den Fingern konnte der Inhalt des Tiegels ohne Probleme zerbröselt werden. Nach mehrmaliger Wiederholung dieses Versuches mit nachfolgenden Abänderungen der Zusammensetzung, der Wattleistung sowie Einschaltzeit der Mikrowelle wurde kein gutes Ergebnis erzielt, deshalb wurde dieser Versuch wie folgt optimiert:
Es wird 2 g Zink (Zn) und 4 Kupfer (Cu) homogen vermischt und diese Mischung im Porzellantiegel bei 800 Watt 10 Minuten erhitzt. Dabei wurde ein sehr gutes Ergebnis der Herstellung des Gelbmessings erzielt. Diese Versuchsdurchführung konnte auch erfolgreich wiederholt werden.
|
| Erklärung und Musterergebnis | Nach kurzer Zeit fängt der Tiegel in der Mikrowelle an zu glühen. Nachdem 10 Minuten verstrichen sind, befreit man den Inhalt vom Tiegel. Es ist eine Oxidschicht erkennbar. Unter dieser Schicht befindet sich das Gelbmessing (meist ein kleiner goldener Tropfen). Auf dem Amboss ist es mit dem Hammer verformbar. Kupfer und Zink bilden eine Verbindung (CuZn), je nach Zusammensetzung können sich die Ergebnisse voneinander unterscheiden. |
| 5-2. Bologneser Leuchtstein | zum Seitenanfang  |
Der Bologneser Leuchtstein ist ein anorganischer Luminophor, das im Jahre 1602 als erstes von dem Schuster Vincentinus Casciarolus in Bologna hergestellt wurde. Es war der erste anorganische Luminophor, bei dem die Darstellung beschrieben wurde. Durch Glühen von Schwerspat und Weizenmehl wurde der Bologneser Leuchtstein hergestellt.
| Ziel des Versuchs | Herstellung eines Bologneser Leuchtsteins mit Bariumsulfat (BaSO4) und Weizenmehl. |
| Reaktionsgleichung | |
| Geräte und Chemikalien | GST-Element, Gasbetonstein, Haushaltsmikrowellenherd (800 Watt), Tiegelzange, Mörser mit Pistill, Spatel, UV-Lampe, Bariumsulfat (BaSO4), Weizenmehl. |
| R- und S-Sätze |
|
| Gefahrensymbole |
|
| Durchführung [4] | Es wird 3 g Bariumsulfat (BaSO4) mit 5 g Weizenmehl sorgfältig vermischt und in einen Porzellantiegel in das GST-Element auf den Gasbetonstein gegeben. Bei 400 Watt wird 10 Minuten geglüht. Nach dem Abkühlen wird der Inhalt des Tiegels unter einer UV-Lampe (265 nm) ausgebreitet und diese nach einigen Sekunden ausgeschaltet. |
| Beobachtung |
Dieser Versuch wurde bei 360 Watt durchgeführt, da 400 Watt nicht einstellbar waren. Dafür wurden 12 Minuten geglüht. Unter dem UV-Licht war keine Lumineszenz zu sehen. Daraufhin wurde der Versuch optimiert: Es werden 3 g Bariumsulfat (BaSO4) mit 4 g Weizenmehl vermischt, in einen Porzellantiegel gegeben und bei 360 Watt 12 Minuten geglüht. Danach wird der Inhalt des Porzellantiegels unter einer UV-Lampe ausgebreitet. |
| Beobachtung |
Nach dem Glühen entstand ein weißgrauer poröser Feststoff. Unter der UV-Lampe (265 nm) luminesziert dieser poröse Feststoff orange; jedoch nur vereinzelt und sehr schwach. Dies wurde verbessert, indem der Feststoff mit einem Spatel zerkleinert wurde. Zu erkennen waren nun vereinzelt stark leuchtende Punkte.
Durch Reduktion des Schwefels von +6 nach -2 entstand Bariumsulfid (BaS) und Kohlenmonoxid (CO). Die entstandene Sulfid-Verbindung ist für den Geruch nach verfaulten Eiern verantwortlich. Dieser Versuch wurde auch mit einem Brenner durchgeführt. Dabei wurde die gleiche Zusammensetzung wie bei der Optimierung benutzt. Jedoch fiel das Ergebnis nicht so gut aus wie mit der Mikrowelle. Unter der UV-Lampe ist nur ein schwaches Leuchten zu sehen. |
| 5-3. Glasherstellung | zum Seitenanfang  |
Vorversuch Glasherstellung
Bevor man mit der Glasherstellung anfängt, ist empfehlenswert, Vorversuche durchzuführen, wie z. B. Herstellung von Boraxperlen.
| Ziel des Versuchs | Herstellung einer Boraxperle mit einem Brenner. |
| Geräte und Chemikalien | Borax (Na2B4O7 x 10 H2O), Magnesiastäbchen, Tüpfelplatte, Brenner mit Schlauch |
| R- und S-Sätze |
|
| Gefahrensymbole |
|
|
Um die Boraxperlen zu färben, können folgende Chemikalien verwendet werden: Cobaltoxid CoO (blau), Chrom (III)-oxid Cr2O3 (grün), Eisen (III)-oxid Fe2O3 (gelb), Kaliumpermanganat KMnO4 (braun/violett), Kupfersulfat CuSO4 (türkis), Selen(rot). |
|
| R- und S-Sätze |
|
| Gefahrensymbole |
|
| Durchführung | In eine Mulde der Tüpfelplatte wird Borax hineingegeben. In eine zweite Mulde wird eine bzw. zwei Spatelspitzen der Metallverbindungen für die Färbung hinzugegeben. Das Magnesiastäbchen wird an einem Ende über den Brenner gehalten, bis es anfängt zu glühen. Wenn es glüht, wird es schnell in das Borax (Na2B4O7 × 10 H2O) getaucht und danach wieder in die Brennerflamme gehoben. Durch Drehen in der Brennerflamme wird das Borax geschmolzen und zu einer Perle geformt. Die glühende Perle am Magnesiastäbchen wird in die zweite Mulde mit der entsprechenden Metallverbindung hineingegeben, wobei die Perle wenige Kristalle davon aufnimmt. Die Perle wird wieder in die Flamme gebracht und unter Drehen geschmolzen. Nach dem Abkühlen der Perle bekommt man die gewünschte Boraxperle mit der entsprechenden Farbe. |
| Reaktionsgleichung | Bsp. mit CoO: |
| Beobachtung | 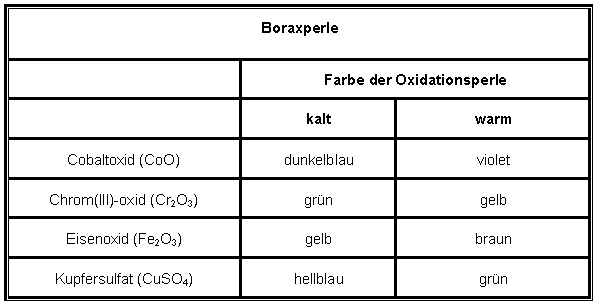 |
| Hinweis | In der qualitativen Analyse wird diese Methode benutzt, um Metalle nachzuweisen. Jedoch haben die Boraxgläser technisch keine Bedeutung, da sie chemisch nicht resident sind. |
Glasherstellung
Glas ist ein amorpher und nicht kristalliner Feststoff. Der Begriff "amorph" kommt aus dem Griechischen und bedeutet "ohne Gestalt". Es gibt eine Vielfalt von unterschiedlichen Gläsern, wie zum Beispiel: Fensterglas, Flaschenglas, Trinkglas und Lampenglas.
Mit der GST-Technik kann bleifreies Glas hergestellt werden. Bei dieser Technik bleibt der Aufbau eines Gebläsebrenners erspart.
| Ziel des Versuchs | Herstellung von verschiedenen Glassorten. | ||||
| Geräte | GST-Element, Gasbetonstein, Haushaltsmikrowellenherd (800 Watt), Tiegelzange, Spatel, Mörser mit Pistill. | ||||
| Chemikalien |
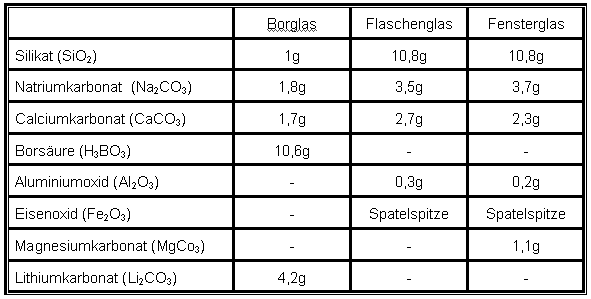
für Borglas: Flaschenglas: Fensterglas: Um die Gläser zu färben, können folgende Chemikalien verwendet werden: Cobaltoxid CoO (blau), Chrom (III)-oxid Cr2O3 (grün), Eisen (III)-oxid Fe2O3 (gelb), Kaliumpermanganat KMnO4 (braun/violett), Kupfersulfat CuSO4 (türkis), Selen(rot). |
||||
| Durchführung [4] [7] |
In den Mörser werden folgende Substanzen hineingegeben und vermischt:
Bei dem Vermischen ist zu beachten, dass keine Verstaubungen auftreten! In die Mischung wird eine bzw. zwei Spatelspitzen der Metallverbindungen für die Färbung hinzugegeben. Die o.g. Mengen reichen für zwei bis drei Porzellantiegel. Der Porzellantiegel wird halb voll gemacht und auf dem Gasbetonstein mit dem GST-Element in der Mikrowelle 10 Minuten bei 800 Watt erhitzt. Nach 10 Minuten wird der Porzellantiegel so schnell wie möglich mit einer Tiegelzange aus der Mikrowelle genommen und der Inhalt wird über eine Keramikplatte ausgegossen (innerhalb von 10 Sekunden). Dabei muss beachtet werden, dass die Glasperlen so klein wie möglich sind, da sie sonst durch die große Spannung zerspringen. |
||||
| R- und S-Sätze |
|
||||
| Gefahrensymbole |
|
||||
| Borglas: |
Optimierung: Der vorgenannte Versuch wurde optimiert. Dazu wurde die Einschaltzeit der Mikrowelle verkürzt. Bei 800 Watt konnte schon nach 5 Minuten ausgeschaltet werden und bei 600 Watt nach 5,5 Minuten. Das Ergebnis war gleich wie bei dem ersten Versuch (10 Minuten bei 800 Watt). Daraus ist zu schließen, dass sich die Dauer der Einschaltzeit nach mindestens 5 Minuten bei 800 Watt bzw. 5,5 Minuten bei 600 Watt nicht auf das Ergebnis auswirkt.
Die verwendeten Porzellantiegel konnten nach der Herstellung von Borglas nicht mehr für andere Versuche verwendet werden. Denn bei jedem Herstellungsversuch blieben Reste im Tiegel hängen. Nachdem viele Tiegel dafür verwendet wurden, kam die Idee auf, diese Tiegel wieder zu säubern. Wir versuchten dies mit einem Soda-Aufschluss. Der zu säubernde Porzellantiegel wurde 2/3 mit Soda (Na2CO3) gefüllt und in das GST- Element hineingegeben, der im Hot-Spot liegt. Die Mikrowelle wurde 10 Minuten bei 800 Watt eingeschalten. Schon nach ein paar Minuten fing der Porzellantiegel an zu glühen. Das Ergebnis brachte nicht den erhofften Erfolg, da der Porzellantiegel nicht vollständig gesäubert werden konnte. Daraus ist zu schließen, dass der Soda-Aufschluss nicht geeignet ist. |
||||
| Flaschenglas: | Die Mischung schmolz innerhalb der 10 Minuten zusammen. Nach 10 Minuten wurde versucht, den Inhalt des Tiegels auf eine Keramikplatte zu gießen, jedoch ohne Erfolg. Die Glasschmelze ist zu viskos um sie ausgießen zu können. Mit einem Spatel konnte die Glasschmelze ohne Probleme verformt werden. | ||||
| Fensterglas: | Hier wurde die Glasmischung 10 Minuten lang in der Mikrowelle geglüht. Es kam das gleiche Problem wie beim Flaschenglasherstellung auf. Die Glasschmelze war zu viskos, um sie auf die Keramikplatte ausgießen zu können. Diese Glasschmelze konnte ebenso mit einem Spatel ohne Probleme verformt werden. | ||||
| Die hohe Viskosität der Flaschenglas- und Fensterglasherstellung ist damit zu erklären, dass bei beiden Glasmischungen deutlich mehr Silikat verwendet wurde. Dies führte zu der hohen Viskosität. Aus diesem Grund ist die Borglasherstellung als Schulversuch besser geeignet als Flaschenglas- bzw. Fensterglasherstellung. | |||||
| 5-4. Thenards Blau | zum Seitenanfang  |
Thenards Blau ist ein himmelsblaues Pigment mit der Formel CoAl2O4. Dieses Pigment wird u.a. verwendet um Kobaltglas herzustellen. Der französische Chemiker Louis-Jacques Thenard stellte Thenards Blau durch Glühen von Kobaltkarbonat mit Aluminium (III)-oxid und Kaliumchlorid als Flussmittel dar. Im Pigment liegt das Kobaltoxid sehr stabil vor und ist daher gesundheitlich nicht schädlich, da es chemisch schwer abbaubar ist.
| Ziel des Versuchs | Herstellung eines Farbpigmentes. |
| Geräte und Chemikalien | GST-Element, Gasbetonstein, Haushaltsmikrowellenherd (800 Watt), Tiegelzange, Mörser mit Pistill, Becherglas (100 ml), Brenner mit Schlauch, Filtertrichter mit Papierfilter, Kobaltkarbonat, Aluminium (III)-oxid, Kaliumchlorid, Salzsäure w (HCl) = 25 %, Wasser. |
| R- und S-Sätze |
|
| Gefahrensymbole |
|
| Durchführung nach Vorschrift [5] | 1,7 g Kobaltkarbonat, 2 g Aluminium (III)-oxid und 5,5 g wird im Mörser sorgfältig gemischt. Die Mischung wird im Tiegel des GST-Elements bei 400 Watt 5 Minuten in der Mikrowelle geglüht. Nach dem Abkühlen wird der Inhalt des Tiegels in einem Mörser pulverisiert. Dieses Pulver wird in einem Becherglas mit ca. 20 ml Salzsäure auf dem Brenner 5 Minuten gekocht. Der Inhalt wird auf Raumtemperatur abgekühlt und mit ca. 50 ml Wasser verdünnt. Danach wird der Feststoff filtriert und getrocknet. |
| Auswertung |
Nach der o.g. Versuchsvorschrift war es nicht möglich ein Thenards Blau herzustellen. Aus diesem Grund wurde ein neuer Versuch mit einer anderen Vorschrift wie folgt durchgeführt: Es wird eine Lösung aus Kobalt(II)Nitrat und Aluminiumsulfat (Verhältnis 1:2) hergestellt. Mit 2 Molare Ammoniak wird diese Lösung auf pH 6-7 gebracht. Es fallen die Hydroxide von Kobalt und Aluminium aus, die danach abfiltriert und im Trockenschrank getrocknet werden. Nach dem Trockenvorgang kommt dieser Feststoff in einen Porzellantiegel und wird bei 800 Watt 4 Minuten geglüht. |
| R- und S-Sätze |
|
| Gefahrensymbole |
|
| Ergebnis |
Es entstand ein himmelsblauer pulverisierter Feststoff.
|
Es wurden weitere Versuche durchgeführt:

Nach diesen Versuchen ist zu schließen, dass mindestens 4 Minuten geglüht werden muss, um Thenards Blau herzustellen.
| 5-5. Aluminiumreguli | zum Seitenanfang  |
| Ziel des Versuchs | Die Veränderung der physikalischen Eigenschaften einer Alufolie |
| Geräte und Chemikalien | GST-Element, Gasbetonstein, Haushaltsmikrowellenherd (800 Watt), Porzellantiegel, Keramikplatte, Filtertrichter mit Filterpapier, Schere, Becherglas, Brenner mit Schlauch, Aluminiumreste (wie z. B. Teelichtschalen, Aluminiumfolie), Natriumchlorid, Wasser. |
| Durchführung [6] | Mit der Schere werden kleine Aluminiumstücke zurecht geschnitten. In den Mikrowellenherd wird ein mit etwa 2/3 Natriumchlorid gefüllter Porzellantiegel in das GST-Element hineingestellt. Der Mikrowellenherd wird 10 Minuten bei 800 Watt eingeschaltet. Nach dem Glühen wird das GST-Element mit Tiegel aus dem Mikrowellenherd genommen und auf einer Keramikplatte abgestellt. In die Kochsalzschmelze werden zurechgeschnittene kleine Aluminiumstücke hineingegeben und danach auf Raumtemperatur abgekühlt. Als nächstes wird auf dem Brenner der Tiegel mit der erstarrten Kochsalzschmelze und Aluminiumstücke in einem Becherglas mit Wasser gekocht, wobei sich das Kochsalz löst. Diese Flüssigkeit wird abfiltriert. Nach diesem Vorgang bleiben auf dem Filter Aluminiumregulis zurück. |
| R- und S-Sätze |
|
| Gefahrensymbole |
|
| Beobachtung und Auswertung | Schon nach wenigen Minuten fing das Natriumchlorid an, flüssig zu werden und zu glühen. Nach dem Glühen blieben nur wenige Sekunden Zeit, um die Aluminiumstücke in die Kochsalzschmelze zu geben, da sich diese sehr schnell abkühlen und dabei fest werden. Es wurde beobachtet, dass die Aluminiumstücke anfangen zu brennen, wenn sie auf die Kochsalzschmelze treffen. Nach wenigen Sekunden ballte sich das Aluminiumstück zusammen und sank dabei auf den Boden des Tiegels und es entstanden Aluminiumregulis. |
| 6. Glasherstellungs-Kit | zum Seitenanfang  |
Die Idee bei dieser Aufgabe ist, dass Schulklassen die Möglichkeit bekommen Experimente mit der Haushaltsmikrowelle durchzuführen. Dabei werden die Schüler*innen Borglas herstellen. Da die Schüler*innen mit diesem chemischen Experiment wahrscheinlich noch unerfahren sind, sollte es so einfach wie möglich sein und da die Lehrer*innen kaum Zeit haben, wird soviel wie möglich vorher hergestellt bzw. bereitgestellt.
Das Glasherstellungs-Kit beinhaltet:
- 10× Glasmischungen
- 2× Tonblumentopf
- Mörtel
- 2× Porzellantiegel
- 1× Skript
- 1×Fragebogen
Die Chemikalien für die Färbung der Gläser wird nicht mitgeschickt, da man nicht weiß, wie die Schüler*innen ihre Gläser färben wollen. Daher sollten die Lehrer*innen diese Chemikalien bei ihrer eigenen Chemikalienausgabe besorgen. Die Glasmischungen sind in kleine Tütchen verpackt. Jede Tüte reicht für einen Porzellantiegel.
Die Glasmischungen beinhalten Silikat (SiO2), Natriumkarbonat (Na2CO3), Caciumkarbonat (CaCO3), Borsäure (H3BO3) und Lithiumkarbonat (Li2CO3).
| 7. Zusammenfassung / Summary | zum Seitenanfang  |
In unserer Projektarbeit befassten wir uns mit verschieden Schulversuche im Bereich der Hochtemperatur Chemie in der Mikrowelle, wobei die Graphit-Suszeptor-Tiegel-Technik (GST-Technik) genutzt wurde.
Dabei war die Zielsetzung unserer Projektarbeit, Schulversuche zu optimieren und den Lehrkräften diese Art von Versuchen möglichst nutzvoll zu vermitteln, da sie diese Versuche in ihren Unterricht einbringen müssen. Dabei wurden folgende Versuche ausgesucht und optimiert:
- Darstellung von Gelbmessing
- Bologneser Leuchtstein
- Glasherstellung
- Thenards Blau
- Aluminiumreguli
Alle Versuche wurden so optimiert, dass man sie leicht verstehen und durchführen kann. Ebenso, dass sie mit weniger Chemikalien bzw. weniger Leistung (Watt) in relativ kurzer Zeit durchgeführt werden können. Dabei wurde beachtet, Chemikalien zu benutzten, die nicht gefährlich und nicht zu teuer waren.
Eine weitere Aufgabe bei unserer Projektarbeit war ein Glasherstellungs-Kit für Schulen zu erstellen. Die Schulen bekamen bzw. bekommen die Borglasmischung schon fertig angesetzt; nur das GST-Element müssen die Lehrer*innen vorher selbst herstellen. Sie bekamen jedoch alle Chemikalien zur Herstellung sowie eine einfache und verständliche Broschüre zur Versuchsdurchführung mitgeliefert.
Summary
Our project report analysed different labour test in the range of microwaves which were done in schools. It has to be mentioned that Graphit-Suszeptor crucible technic (GTS technic) is used.
The target was the optimisation of these labour test, that the teachers are able to show these tests easily to their students. Therewith the students can understand the content and expand their knowledge.
We have chosen and optimised following labour tests.
- Description of Gelbmessing
- Bologneser Leuchtstein
- Glass making
- Thenards Blau
- Aluminiumreguli
Our target was the optimisation of these tests by reducing the amount of chemicals, power [watt] or the time.
We paid attention especially to the chemicals, which are not hazardous and low-priced.
A further task of our project report was the creation of a Glasherstellungs-Kit for using in schools.
A Borglasmischung, which is already prepared, will be delivered to the schools. The teacher only has to produce the GTS Element but all components for the preparation will be delivered.
For the production an easy execution of the test will be provided.
| 8. Schlusswort | zum Seitenanfang  |
Wir bedanken uns für die Möglichkeit diese interessante Projektarbeit bearbeiten zu dürfen. Durch die Projektarbeit "Schulversuche in der Mikrowelle" konnten wir tiefe Einblicke in die Mikrowellentechnik und deren Leistung gewinnen. Es hat uns sehr viel Spaß gemacht immer wieder festzustellen, was man alles mit einem normalen Haushaltsmikrowellenherd herstellen kann.
| 9. Literaturverzeichnis / Bezugsadressen / Bildnachweise | zum Seitenanfang  |
Bezugsadressen
- Feuerfest Mörtel K II (bis 1.400 °C), 5 kg Eimer, FES Feuerfest Siegburg, Peter Lichtenberg GmbH & Co. KG, 53894 Mechernich - Satzvey
erhältlich in Baumärkten - Graphit-Spray - Graphit 33, 200 ml, Art. Nr. 20.760.6.09.12.01, CRC Industries Deutschland GmbH, 76473 Iffezheim
erhältlich bei Conrad electronic - Blumentopf aus Ton (100 ml)
erhältlich in Baumärkten
Literatur
[3] Dr. Björn Lippold: Der Einzug der Mikrowellentechnik ins Labor.
http://www.chemie.de/articles/d/43025/ (5.1.08)
[5] G. Jander, E. Blasius, Lehrbuch der analytischen und präperativen anorganischen Chemie, Stuttgart, 472
[6] Lühken, Arnim: Ultraschall und Mikrowellenstrahlung im Chemieunterricht. Datum der Ausgabe: 3.2005
http://deposit.ddb.de/cgi-bin/dokserv?idn=977924068&dok_var=d1&dok_ext=pdf&filename=977924068.pdf (30.11.07), Seite 197
[4] Lühken, Arnim / Bader, Hans Joachim (2001) Aufsatz "Hochtemperaturchemie im Haushalts-Mikrowellenofen", CHEMKON, WILEY-VCH Verlag GmbH, D-69451 Weinheim
[2] Meyers Lexikonverlag: Magnetron. Datum der Ausgabe: 27 Februar 2007 15:31 UTC http://lexikon.meyers.de/meyers/Magnetron (14.1.08),
und http://www.itwissen.info/definition/lexikon/__magnetron_magnetron.html
[1] http://de.wikipedia.org/wiki/Mikrowellenherd
[7] http://www.xlab-goettingen.de/pics/medien/1_1149152456/farbiges_Glas.pdf
Bildnachweise
- Gefahrensymbole: http://www.gefahrstoffe-im-griff.de/50.htm
- Abb.1 "Mikrowellenofen" © CMA - Food, School & Life - das kostenlose Lehrermagazin
- Abb.2 "Magnetron" © Harald Chmela, Richard Smetana / http://www.hcrs.at/ICONS/_MAGTRO2.JPG
- Abb. 4 Alexander Tsapanidis
- Abb. 5 Alexander Tsapanidis
- Abb. 6 Alexander Tsapanidis
- Abb. 7 Alexander Tsapanidis
- Abb. 8 Alexander Tsapanidis
- Abb. 9 Alexander Tsapanidis
- Abb. 10 Alexander Tsapanidis
- Abb. 11 Alexander Tsapanidis
| 10. Anhang | zum Seitenanfang  |
| 10-1. Broschüre | zum Seitenanfang  |
Broschüre "Schulversuche in der Mikrowelle - Hochtemperaturversuche"
(18 Seiten, PDF-Dokument)
| 10-2. Glasherstellungs-Kit Broschüre | zum Seitenanfang  |
Glasherstellungs-Kit Broschüre
(7 Seiten, PDF-Dokument)
« zurück zur Übersicht - Projektarbeiten