« zurück zur Übersicht - Projektarbeiten
"Transmutation und Amalgamierung"
von Erich-Dirk Göllner und Kerstin Wiedmann (Schuljahr 2009/10)
| Vorwort | zum Seitenanfang  |
Wir möchten dem Institut Dr. Flad für die Ermöglichung dieser Projektarbeit danken. Ohne die Beteiligung der Schule am UNESCO-Weltkulturerbetag wäre dieses Thema nicht erschlossen worden. Weiterhin möchten wir Herrn Wolfgang Flad und Herrn Jürgen Flad für ihre Ratschläge, Hilfestellungen und den Fototermin danken, sowie Frau Pfiz, die uns während dem gesamten Weltkulturerbetag mit Rat und Tat zur Seite stand.
Vor allem möchten wir Prof. Dr. Georg Schwedt für die Betreuung der Projektarbeit und ebenso für seine Hilfe und sein Vertrauen in uns während dem Verlauf der Projektarbeit danken.
Ein besonderer Dank geht auch an die Assistenten, die uns bei den Laborversuchen unterstützt haben.
| 1. Zusammenfassung | zum Seitenanfang  |
Bei unserer Projektarbeit handelt es sich um die elektrochemische Spannungsreihe in weiterem Sinne, besonders jedoch um ihre Rolle in der Alchemie des 15. Jahrhunderts (Transmutation und Amalgamierung). Es wird der Transmutationsbegriff im Wandel der Zeit beleuchtet und viele Anwendungen von Amalgamen beschrieben. Ein weiterer Schwerpunkt ist der UNESCO-Weltkulturerbetag am 07. Juni 2009 im Kloster Maulbronn, den wir als "Adepten" von Prof. Dr. Schwedt besuchten und dort nicht nur einen Stand mit Experimenten führten, sondern auch noch einen Experimentalvortrag von Prof. Schwedt unterstützten. Im Verlauf der Arbeit haben wir verschiedene Experimente zu dem Thema Transmutation und Amalgamierung durchgeführt.
| 2. Summary | zum Seitenanfang  |
Our project work is about the electrochemical redox potentials by extension and, more specifically, about its role in the alchemy of the 15th century (transmutation and amalgamation). Another focus is the UNESCO world heritage day in 7th of june in 2009 situated in the convent of Maulbronn, which we visited as "adepts" of Prof. Dr. Schwedt, and were we had a stand with experiments and also supported a presentation of Prof. Schwedt. In the course of this project work, we conducted some experiments of the topic of transmutation and amalgamation as well as examinated the historical backgrounds them in more detail.
| 3. Einleitung | zum Seitenanfang  |
Die Umwandlung unedler, wenig wertvoller Materialien in edle, wertvolle Dinge war die Haupttriebkraft der Alchemie. Für jeden Alchemisten war das oberste Ziel, den "Stein der Weisen" zu finden, mit dem Eisen in Gold verwandelt werden konnte. Im Folgenden wollen wir zeigen, dass Transmutationen, nach dem damaligen Verständnis, tatsächlich möglich sind. Wir durchleuchten dabei die Theorie der Reaktionen wie auch die praktischen Ausführungen einiger Versuche rund um die Transmutation und Amalgamierung, welche wir auch am UNESCO-Weltkulturerbetag vorführten. Dabei sind Transmutation und Amalgamierung keineswegs nur historische Themen, sondern finden auch heute noch vielfache Anwendungen im technischen Bereich.
| 4. Transmutation | zum Seitenanfang  |
Es war seit jeher ein Menschheitstraum beliebige Mengen an Gold und Silber herzustellen. Dies war sozusagen der Beginn der Alchemie, die ca. im 1. Jahrhundert n. Chr. im damals hellenistisch geprägten Ägypten entstand.
Die Alchemie untergliedert sich in zwei wichtige Bereiche. Zum Einen den spirituellen Aspekt, dessen Ziel die Vervollkommnung und Läuterung der Seele des Alchemisten durch die "Erlösung" der Materie ist. Zum Anderen verfolgten die Alchemisten das Ziel unedle Metalle zu vervollkommnen, d.h. durch deren Umwandlung (Transmutation) Gold oder Silber zu erhalten. 1
Vor allem in Zeiten wirtschaftlicher Not bestand die Hoffnung aus billigeren Materialien Gold herzustellen. Mit der Zeit entwickelte sich in der Antike die Idee vom Stein der Weisen (Lapis philosophorum). Darunter stellten die Alchemisten sich ein Agens vor, welches bereits in sehr kleinen Mengen hinzugegeben die Transmutation eines unedlen Metalls bewirken sollte. Der Stein wurde als roter, schmelzbarer, feuerbeständiger Körper oder Pulver mit hoher Dichte beschrieben. Dieser rote Stein der Weisen sollte zur Transmutation von unedlen Stoffen in Gold dienen. Es wurde im 13. Jahrhundert auch noch eine zweite Form beschrieben: ein weißer Stein der Weisen der die Transmutation zu Silber bewirken sollte. Die Darstellung des Stein der Weisen war ein gut gehütetes Geheimnis und es gab einen selbst auferlegten Moralkodex unter den Alchemisten, ihr Wissen nur in Verschlüsselungen bzw. überhaupt nicht preis zu geben. 2
Alle Alchemisten verschrieben sich dem Opus magnum, dem "Großem Werk". Dies diente zur Herstellung des Stein der Weisen und der Höhe- und Schlusspunkt des Opus magnum war dann eine erfolgreiche Metallumwandlung. Es gab viele verschiedene Arbeitsvorschriften, mit unterschiedlichen Angaben zur Dauer und verwendeten Materialien, zur Synthese. Die Darstellung erfolgte meistens in einem hermetisch abgeschlossenen Gefäß, in welchem die Ausgangssubstanz lange erhitzt wurde. Häufig wurde als Ausgangsmaterial Quecksilber verwendet. Gemeinsam hatten alle Herstellungsmethoden eine charakteristische Farbfolge, die die Entstehung des Steines kennzeichnete. Zunächst wurde das Ausgangsmaterial schwarz. Die Schwärze, auch Nigredo genannt, stand für den Urzustand der Materie. Darauf folgten mehrere Farbstufen, häufig gelb-grün-weiß-irisierend (Pfauenschwanz) und eine abschließende Rotfärbung (Rubedo) signalisierte den Erfolg des Prozesses. Nun musste der erhaltene Stein der Weisen durch weitere Arbeitsvorgänge für die Transmutation vorbereitet gemacht werden. Abschließend folgte dann die Projectio(n). Zu einer großen Menge geschmolzenen unedlen Metalls wurde eine kleine Menge des Steines in einen Schmelztiegel gegeben und verschlossen. Nach kurzer Zeit erfolgte die Umwandlung des Tiegelinhaltes zu Gold. 3
Die Frage auf welche Art und Weise der Stein der Weisen Metallumwandlungen möglich machte wurde stark variierend beantwortet. Es wurden ihm übernatürliche Kräfte oder die Fähigkeit zu heilen zugesprochen. Im Mittelalter bezeichneten einige Alchemisten unedle Metalle als krank oder unreif und der Stein der Weisen heile sie oder erlöse die Metalle aus ihren unreifen Rohzustand. Er wurde mit einem Katalysator verglichen, der den Reifungsprozess der Metalle beschleunige. Gold wurde als die höchste vollkommene Form angesehen. Eine schlüssige, beweisbare Antwort wusste niemand zu liefern. 4
Gegen Ende des 13. Jahrhunderts wurde in einer alchemistischen Schrift von Geber, der Summa perfectionis magisterii (Die höchste Vollendung des Meisterwerks), die grundlegend neue Lehre der Ordnung der Transmutationsmittel veröffentlicht. Nach dieser Lehre gibt es drei verschiedene Ordnungen von Transmutationsmitteln:
1. Ordnung: Agentien, die nur eine vorübergehende, oberflächlichen Wandel bewirken
2. Ordnung: Agentien, die einen tatsächlichen Wandel bewirken ,aber nur in der Qualität, wie z. B. Schwere oder Glanz
3. Ordnung: Agentien, die unedle Metalle tatsächlich in Gold oder Silber umwandeln
Die unterschiedliche Wirkungskraft der Transmutationsmittel geht auf die Beschaffenheit der Materienteilchen zurück; je feiner die Teilchen des Agens, desto stärker die Transmutationskraft. 5
Albertus Magnus (vor 1200-1280), ein Universalgelehrter, untersuchte die Ursache der Bildung von Metallen und die Realisierbarkeit einer Transmutation. Er stellte fest, dass es durch bestimmte Prozesse tatsächlich möglich sei den Geruch, die Farbe oder das Gewicht von Metallen zu verändern, aber bis dahin noch niemand echtes Gold hergestellt habe. Magnus unterschied schließlich tatsächliche Metallumwandlungen von scheinbaren, bei denen nur das Aussehen der Metalle verändert wurde. Auf diesen "scheinbaren" Transmutationen basierten die sensationellen Schaustellungen, die die Alchemisten damals lieferten und ihnen beachtliche Positionen an Fürsten-/ und Königshöfen einbrachten. Ein Großteil der scheinbaren Transmutationen ist heute durch die elektrochemische Spannungsreihe erklärbar, die der Italiener Alessandro Volta (1745-1824) aufstellte. 6
Der Glaube an die Durchführbarkeit von tatsächlichen Metallumwandlungen zu Gold oder Silber hielt sich bis Ende des 17. Jahrhunderts. Mitte des 18. Jahrhunderts gab es immer noch Chemiker und Physiker, die an dieser Idee festhielten, z. B. James Price (1752-1783). Jedoch wurden sie als Schandfleck betrachtet und von der restlichen chemischen Gesellschaft verpönt. Price, der sein komplettes Vermögen für alchemistische Experimente ausgegeben hatte, wurde von den Mitgliedern der Royal Society aufgefordert eine seiner angeblichen Transmutationen vor ihnen zu wiederholen. Daraufhin beging er Selbstmord. 7
Erst durch den Wachstum der Chemie im 19. Jahrhundert erhielten die alchemistischen Spekulationen neuen Aufwind. Die wachsende Skepsis gegenüber der steigenden Anzahl an Elementen, die Entdeckung der Spektroskopie, die Wiedereinführung des Atomismus durch Dalton und die Regelmäßigkeit des Periodensystems ließen Experimente zur Transmutation wieder in Mode kommen. Durch Ernest RUTHERFORDS und Frederick SODDYS Arbeit über Radioaktivität wurde der Glaube an tatsächliche Metallumwandlungen Anfang des 20. Jahrhunderts endgültig wieder gesellschaftsfähig. Und in den 1930er Jahren auf atomarer Ebene physikalisch realisiert. 8
1980 gelang Wissenschaftlern die Sensation. Mit Hilfe des Teilchenbeschleunigers, im Lawrence Laboratory der Universität Kalifornien, Berkeley wurde Wismut in echtes Gold umgewandelt. Das Experiment kostete $10.000 und das gewonnene Gold hatte einen Marktwert von lediglich einem piko Cent. 9
Heute ist es also tatsächlich möglich in einem Kernreaktor durch Bestrahlung von Quecksilber oder Platin Gold darzustellen. Jedoch ist dieses Verfahren unwirtschaftlich und daher von geringer Bedeutung.
Platin als Ausgangsmaterial ist nämlich teurer als das entstehende Gold und von Quecksilber kann nur ein bestimmtes Isotop (196Hg) verwendet werden. Dieses Isotop macht nur einen geringen Prozentteil in natürlich vorkommendem Quecksilber aus und bei alle anderen Quecksilberisotopen entsteht durch langsamen Neutronenbeschuss indirekt nur Thallium. 10
In der Kerntechnik wird mit dem Begriff Transmutation die Umwandlung von Atomkerne in andere Isotope beschrieben. Zum Einen werden so bestimmte Plutonium-/ und Uranisotope hergestellt. Zum Anderen hofft man dadurch radioaktiven Abfall beseitigen zu können, indem man langlebige, zum Teil radiotoxische Atomkerne in kurzlebigere umwandelt. An diesem Verfahren zur Beseitigung nuklearen Abfalls wird jedoch bis jetzt nur geforscht. 11
| 5. Elektrochemische Spannungsreihe | zum Seitenanfang  |
Bei dem Versuch zur Transmutation wird ein Eisennagel in eine Kupfersulfat-Lösung getaucht. Es scheidet sich sofort eine gut erkennbare dunkle Schicht auf dem Nagel ab, elementares Kupfer.
Die geschieht dadurch, dass das Eisen des Nagels unter Abgabe von Elektronen in Lösung geht, während die Kupfer2+-Ionen unter Aufnahmen von Elektronen die Lösung verlassen und sich auf dem Nagel absetzen.
Den Vorgang der Elektronenabgabe nennt man Oxidation.
Den Vorgang der Elektronenaufnahme nennt man Reduktion. 12
Bei diesem Versuch wird also das Eisen oxidiert und die Kupfer-Ionen reduziert.
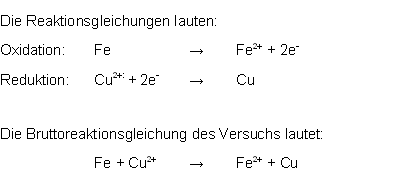
Hierdurch wird ersichtlich, dass das Eisen die Kupfer-Ionen reduziert.
So eine Reaktion wird "Redoxreaktion" genannt, da es sich um Reduktions- und Oxidationsvorgänge handelt.
Sie läuft freiwillig und ohne äußere Einflüsse ab, da das Eisen eine größere Neigung hat Elektronen abzugeben als das Kupfer.
Ob eine Redoxreaktion freiwillig abläuft, gibt die so genannte EMK, die Elektromotorische Kraft, an. Ist sie mit einem positiven Vorzeichen versehen, bedeutet dies, dass die Reaktion freiwillig abläuft, ist die EMK negativ, bedeutet es, sie läuft nicht freiwillig ab und muss durch äußere Einflüsse in Gang gebracht werden. 13
Berechnet wird sie mit folgender Gleichung:

Eine Faustregel besagt: Je größer der EMK-Wert, desto schneller läuft eine Reaktion ab.
Das elektrische Potential
Wird statt einem Eisennagel eine Kupferelektrode in eine Kupfersulfat-Lösung getaucht, entsteht ein Redoxgleichgewicht, das zur Bildung eines Potentials (lat. Potentia = Arbeitsvermögen) beiträgt.
Es entsteht durch zwei Vorgänge, den Lösungsdruck und den Abscheidungsdruck.
Der Lösungsdruck ist das Bestreben des Metalls der Lösung mehr Ionen zuzuführen, das heißt selber oxidiert zu werden.
Der Abscheidungsdruck bezeichnet das Bestreben der Ionen der Lösung sich als Element an der Elektrode abzuscheiden, also selber reduziert zu werden.
Durch diese zwei Bestrebungen entsteht folgendes Gleichgewicht:
![]()
Den oben genannten Versuchsaufbau bezeichnet man als galvanisches Halbelement.
Das Potential, das entsteht kann aber nicht absolut gemessen werden, sondern nur in Relation zu anderen Potentialen. Dies erfolgt durch Aneinanderschaltung von zwei galvanischen Halbelementen. Die definierte Bezugsgröße ist das Potential von Wasserstoff.
Das Potential von Wasserstoff wird in der Normalwasserstoffelektrode (NWE) gemessen. Sie liefert gute, reproduzierbare Ergebnisse. Diese Elektrode taucht in der wässrigen Lösung einer Säure (pH = 0), besteht aus Platin und wird bei 25°C von Wasserstoffgas unter einem konstanten Druck von 1 bar umspült.
Das Potential der NWE wurde als 0 definiert. 14
Bei Aneinanderschaltung einer NWE und eines anderen galvanischen Halbelements (hier: Kupfer in Kupfersulfat-Lösung, Cu/Cu2+) kann die Potentialdifferenz zur NWE bestimmt werden.
Ist die Potentialdifferenz positiv, also das Potential der anderen Halbzelle größer als das Potential der NWE ist das Metall schwerer oxidierbar als Wasserstoff. Im Umkehrschluss gilt, dass bei einem niedrigeren Potential das Metall leichter zu oxidieren ist als Wasserstoff.
Aufgrund dieser Potentialunterschiede hat man verschiedene Redoxsysteme in der so genannten Redoxreihe oder Spannungsreihe geordnet.
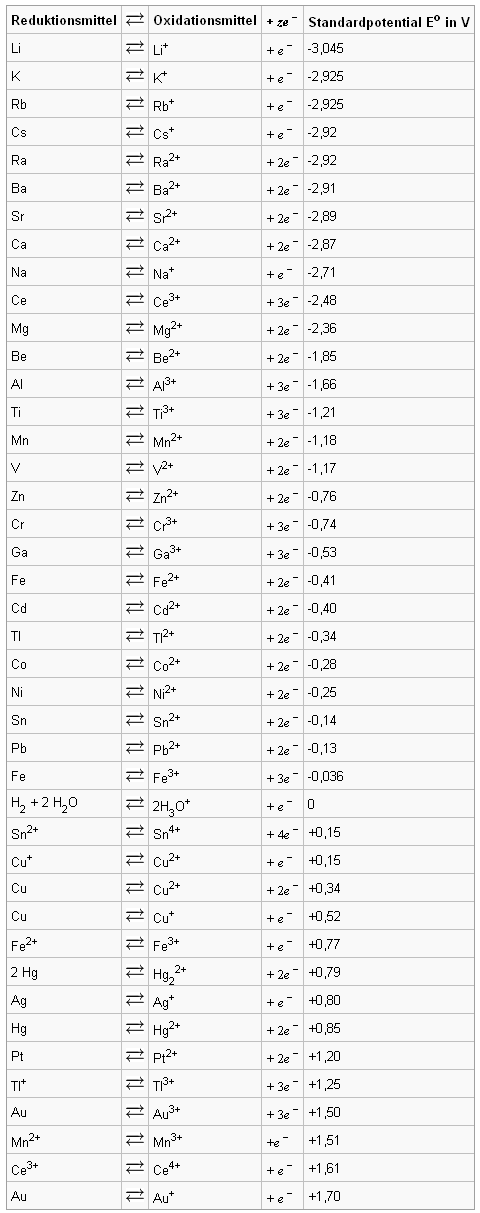
Tabelle: Spannungsreihe (© wikibooks.org)
Je größer das Potential in der Tabelle, desto "edler" ist das Element. Sie stellen die Standardpotentiale dar, die sich bei Verbindung mit einer NWE in einer galvanischen Zelle ergeben. Sie gelten allerdings nur für Lösungen mit der Konzentration 1 mol·L-1 unter Standardbedingungen . Will man die Potentiale bei anderen Konzentrationen oder Bedingungen ausrechnen, wird die Nernst' sche Gleichung benötigt. 15
Nernst'sche Gleichung:

| 6. Amalgamierung | zum Seitenanfang  |
Als Amalgame bezeichnet man Lösungen aus Legierungen oder Metallen in Quecksilber.
Das Wort Amalgam stammt vermutlich von dem griechischen Wort malagma ( = Erweichung) ab. Quecksilber liegt als einziges Metall bei Zimmertemperatur als Flüssigkeit vor. Es war bereits im Altertum als Metall bekannt und galt als die Mutter der Metalle. Außerdem verglich man es mit flüssigem Silber. Daher leitet sich auch der Name Quecksilber ab (althochdeutsch quecsilber = lebendiges Silber). 16
Viele Alchemisten versuchten aus Quecksilber den Stein der Weisen herzustellen oder Quecksilber zu verfestigen. Das feste Quecksilber sei dann so rein, dass es sich ohne Probleme in Gold umwandeln ließe. Eine Amalgamierung von Quecksilber mit anderen Metallen wurde von den Alchemisten häufig mit der körperlichen Vereinigung verglichen. 17
Gewonnen wurde Quecksilber damals aus rotem Zinnober (Quecksilbersulfid) und dann weiterverarbeitet, etwa zu "Pillen der Unsterblichkeit" oder Quecksilbersalbe. Die Salbe erhielt man wenn man Quecksilber zusammen mit Schweinefett verrieb. Sie wurde von vielen Ärzten verschrieben. Obwohl die hohe Toxizität des Quecksilbers, vor allem die seiner Dämpfe bereits damals bekannt war. Quecksilber verursacht die sogenannte Minamata-Krankheit (früher auch Merkurialismus). Bei einer Vergiftung durch Quecksilber kommt es zu einer Störung des Zentralen Nervensystems, die oft tödlich endet. 18
Es gibt sehr viele Amalgame - in flüssiger oder fester Form. Dies ist abhängig vom Quecksilbergehalt. Bei vorwaltendem Quecksilbergehalt liegt das Amalgam bei Raumtemperatur meist flüssig vor.
Die Metalle und Legierungen lösen sich unterschiedlich gut in Quecksilber. Zinn, Zink, Bronze, Blei und Messing sind sehr gut in Quecksilber lösbar. Gold, Kupfer und Silber hingegen lösen sich schwerer und Platin nur sehr schwer. Eisen ist überhaupt nicht in Quecksilber löslich.
Die Verbindungen können entweder unter Temperaturerhöhung oder -erniedrigung entstehen. 19
Die Amalgame waren schon sehr früh von großer Bedeutung und wurden für technische Verfahren benötigt. Amalgame wurden auch als Quickbreie oder Verquickungen bezeichnet.
Im Römischen Reich wurde ein Verfahren zur mechanischen Gewinnung von Gold mittels Amalgamierung entwickelt. Die Goldsucher mischten reines Quecksilber mit goldhaltigem Sand. Das Gold liegt in kleinen Flittern vermengt mit dem Gestein vor. Das edlere Gold bildet mit Quecksilber eine Legierung. Diese Legierung sinkt durch ihr großes Gewicht auf den Boden des Auffangbeckens. Durch das Abrauchen, d.h. Erhitzen der Legierung auf eine Temperatur von 360°C, wird das Quecksilber verdampft und Rohgold bleibt zurück.
Auch heute wird dieses Verfahren noch angewandt. Die entstehenden giftigen Quecksilberdämpfe werden allerdings aufgefangen und dem Prozess wieder zugeführt. 20
Das Abrauchen von Goldamalgamen wird auch bei der Feuervergoldung, die älteste Technik zur Metallvergoldung, benutzt.
Goldamalgame sind bei Zimmertemperatur teigartige Massen mit einem viel tieferen Schmelzpunkt als reines Gold. Das zu vergoldende Metallstück wird entfettet und anschließend verquickt, d.h. es wird in eine Lösung aus Quecksilber und verdünnter Salpetersäure getaucht. Diese Lösung ist wird auch als Quickwasser bezeichnet. Daraufhin kann man das Amalgam z.B. mittels einer Messingbürste aufstreichen. Anschließend wird über einem schwach glühenden Holzkohlefeuer abgeraucht. Die Goldteilchen diffundieren durch die Erwärmung in den Metallgegenstand, während der größte Teil des Quecksilbers verdampft. Die Oberfläche des vergoldeten Gegenstandes ist nun mattgelb und rau. Durch Polieren kann man sie glätten und zum Glänzen bringen.
Seit Mitte des 19. Jahrhunderts findet dieses Verfahren aufgrund der Quecksilberdämpfe nur noch selten Anwendung. Einige Kleinbetriebe restaurieren und fertigen für Museen und Kirchen auf diese Weise edle Gegenstände.
Heutzutage vergoldet man Gegenstände durch Galvanisierung. 21
Im 15. Jahrhundert setzte sich das Amalgamieren von Gläsern zum Belegen von Spiegeln durch. Dabei wurde eine polierte, geschliffene Flachglastafel mit einer Zinnamalgamschicht überzogen. Dieses Verfahren hielt sich lange gegenüber dem von Justus von Liebig (1803-1873) entwickelten Verfahren der Nassversilberung, da es wirtschaftlicher und einfacher war. Erst als 1889 neue Arbeitsschutzbestimmungen eingeführt wurden, wurde das Amalgambelegen durch diese Schutzmaßnahmen so teuer, dass es von dem neuen Verfahren abgelöst wurde. 22
Erstmals im Jahre 1819 wurden Amalgame als Füllung für Zähne eingesetzt, seit 1820 in Massen.
Heutzutage wird für "Plomben" des öfteren Silberzinnamalgam, sogenanntes Zahnamalgam, verwendet. Es gibt zwar gesundheitliche Bedenken und ist äußerst umstritten, jedoch bietet Zahnamalgam einige Vorteile. Es ist preiswerter als andere moderne Füllungskunststoffe und weitgehend fehlertolerant bei der Verarbeitung im Mund mit erschwerten Bedingungen.
Zahnamalgam ist eine sehr widerstandsfähige, dunkelgraue und harte Legierung. Sie besteht zu ca. 50% aus Quecksilber und einer Mischung verschiedenster Metalle, welche zu ca. 40% aus Silber, 32% Zinn, 30% Kupfer, 5% Indium, 3% Quecksilber, 2% Zink zusammengesetzt ist.
Zur Darstellung wird in einem Mischer zu einer Silber-Zinnlegierung Quecksilber gegeben:
![]()
Anfangs besitzt die Masse eine hohe Plastizität, lässt sich gut formen und passt sich allen Zahnhohlräumen an. Jedoch muss das Zahnamalgam schnell verarbeitet werden, da es schon nach ca. 10 Minuten beginnt auszuhärten.
Früher verwendete man billigeres Kupferamalgam, dessen zweiter Hauptbestandteil Kupfer anstatt Zinn ist. Kupferamalgam ist chemisch unbeständig und zersetzt sich durch den Speichelfluss. Mit der Zeit wird Quecksilber frei. 23
Natriumamalgam, mit der Formel Na·Hgx, ist von großer technischer Bedeutung. Es ist ein Reduktionsmittel und entsteht bei der Chlor-Alkali-Elektrolyse als Zwischenprodukt. Dieses zentrale Elektrolyseverfahren dient zur Darstellung von Natronlauge und Chlor, den wichtigsten Hilfschemikalien und Ausgangsprodukten für unterschiedliche Produktionszweige. 24
Als Ausgangsstoff dient Steinsalz. Steinsalz besteht neben anderen Salzen hauptsächlich aus Natriumchlorid. Zunächst wird es in Wasser gelöst und durch Filteranlagen gereinigt. Die dadurch erhaltene Lösung nennt man Reinsole. Sie wird dann in die Elektrolysenzelle geleitet. Bei der Elektrolyse werden an der Anode Chlorid-Ionen zu elementarem Chlor oxidiert:
![]()
Die Vorgänge an der Kathode sind abhängig vom angewendeten Verfahren. Es gibt das Diaphragma-Verfahren, das Membran-Verfahren und das Amalgam-Verfahren. Natriumamalgam spielt nur beim Amalgam-Verfahren eine Rolle.
Dabei wird die elektrische Leitfähigkeit und die Fähigkeit zur Bildung von Legierungen des Quecksilbers genutzt. Als Kathode dient ein dünner Quecksilberfilm auf dem Boden eines geneigten Troges. Darüber befindet sich die Reinsole. In die Reinsole tauchen die Anoden ein. An der Quecksilberkathode werden die Natrium-Ionen zu Natrium reduziert:
![]()
Daraufhin bildet sich sofort eine Verbindung aus Quecksilber und Natrium- Natriumamalgam.
Die Legierung wird dann außerhalb des Elektrolysenvorganges im Amalgamzersetzer mit Wasser zersetzt. Dabei entstehen Natronlauge, Wasserstoff und Quecksilber:
![]()
Das Quecksilber wird in den Elektrolysenprozess zurückgeschleust. 25
Die Gesamtreaktion lautet:
![]()
Die Vorteile dieses Verfahren liegen vor allem in der Qualität des entstehenden Chlorgases und der Natronlauge. Außerdem wird durch die räumlichen Trennung der Bildungsorte von Chlor und Wasserstoff die Entstehung von Chlorknallgas, einem hochexplosivem Gemisch, vorgebeugt. Zudem ist die Soleaufarbeitung relativ einfach.
In den letzten Jahren wurden jedoch viele der Amalgamanlagen durch das Membranverfahren ersetzt. Das Amalgamverfahren verbraucht sehr viel Energie und durch die Verwendung von Quecksilber fallen enorme Kosten für den Umweltschutz an. Außerdem ist der entstehende Wasserstoff quecksilberhaltig. 26
| 7. Praktischer Teil | zum Seitenanfang  |
| 7-1. Außergewöhnliche Transmutationen | zum Seitenanfang  |
Untersucht wird ob die zu erwartende Redoxreaktion bei drei unterschiedlichen Metallen und drei verschiedenen Metall-Ionen-Lösungen sichtbar abläuft. Nach der elektrochemischen Spannungsreihe und den EMK-Werten müsste sich bei allen Versuchen das edlere Metall abscheiden.
Die Lösungen sind Bleinitrat-Lösung, Cobaltchlorid-Lösung und Nickelsulfat-Lösung. Die Konzentration des Metallkations beträgt 0,5 mol*L-1. Die verwendeten Salze waren alle technisch rein.
Als Metalle dienen Aluminiumbleche, Eisennägel und Zink (verzinkte Unterlagscheiben).
Reaktionsgefäße sind Wägegläschen mit einem Volumen von 25ml.
Die Versuche werden im sauren, alkalischen und neutralen Milieu durchgeführt.
Die Standardpotentiale der Metalle betragen:

Die Reaktionsgleichungen lauten:
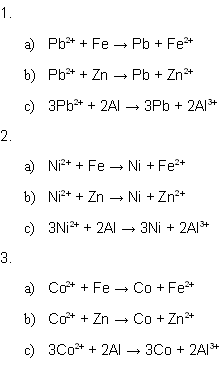
| 7.1.1. Bleinitrat-Lösung |
| 7.1.1.1 Im neutralen Milieu | |
| Durchführung: | Zunächst wird die Bleinitrat-Lösung hergestellt. Dazu werden 16,56g Bleinitrat eingewogen, in einen 100ml-Analysenkolben gegeben und bis zur Marke mit demineralisiertem Wasser verdünnt. Es werden immer 10,0ml Lösung verwendet und mit dem jeweiligen Metall versetzt.
|
| Beobachtungen: |
|
| Ergebnis: |
|
| 7.1.1.2 Im sauren Milieu | |
| Durchführung: | Zu den 10,0ml Bleinitrat-Lösung werden jeweils 1ml konzentrierte Salpetersäure gegeben
|
| Beobachtungen: |
|
| Ergebnis: |
|
| 7.1.1.3 Im alkalischen Milieu | |
| Durchführung: | Zu den 10,0ml Bleinitrat-Lösung wird nach Zugabe des jeweiligen Metalls 1ml Natronlauge (c (NaOH) = 10 mol·L-1) gegeben. Der Bleihydroxidniederschlag wird mit konz. HNO3 wieder in Lösung gebracht.
|
| Beobachtungen: |
|
| Ergebnis: | Bei allen drei Reaktionen findet man einen schwarzen Niederschlag nach Lösen des Bleihydroxides. Es handelt es sich hierbei um abgeschiedenes Blei. Bei Aluminium und Zink haftet das Blei auf dem jeweiligen Metallgegenstand. Beim Eisen hat es sich nur lose abgeschieden und ist dann auf den Gefäßboden gesunken. |
| 7.1.2. Nickelsulfat-Lösung |
| 7.1.2.1 Im neutralen Milieu | |
| Durchführung: | Die Nickelsulfat-Lösung wird aus Nickelsulfat-Heptahydrat hergestellt. Dazu werden 14,04g NiSO4·7H2O eingewogen und in einem 100ml-Analysenkolben mit demineralisiertem Wasser bis zur Marke verdünnt. 10,0 ml der Lösung werden mit einer Vollpipette abgemessen und mit dem jeweiligen Metall versetzt.
|
| Beobachtungen: | Es ist bei keinem der Metalle eine sichtbare Reaktion zu erkennen. |
| Ergebnis: | Trotz der positiven EMK-Werte ist keine sichtbare Abscheidung von Nickel auf den Metallen zu erkennen. |
| 7.1.2.2 Im sauren Milieu | |
| Durchführung: | 10,0 ml Nickelsulfat-Lösung wird mit 1ml konz. HNO3 versetzt und das jeweilige Metall hinzugegeben.
|
| Beobachtungen: |
|
| Ergebnis: |
|
| 7.1.2.3 Im alkalischen Milieu | |
| Durchführung: | 10,0ml Ni2+-Lösung wird mit den unterschiedlichen Metallen und anschließend gleich mit 1ml Natronlauge (c (NaOH) = 10mol·L-1) versetzt. Die ausgefallenen Hydroxid-Niederschläge werden dann mit konz. Salpetersäure in Lösung gebracht.
|
| Beobachtungen: | Sowohl bei Zink, Eisen und auch Aluminium fällt ein grün-weißer Niederschlag aus. Nach Lösen dieses Niederschlags mit Säure ist bei keinem der Metalle ein abgeschiedener Niederschlag zu sehen. |
| Ergebnis: | Bei dem grün-weißem Niederschlag handelt es sich um Nickelhydroxid. Dass kein dunkler Niederschlag nach dem Lösen dieses Niederschlages zurückbleibt, lässt sich darauf schließen, dass nur sehr geringe Mengen Nickel abgeschieden haben, die sogleich wieder mit in Lösung gegangen sind. |
| 7.1.3. Cobaltchlorid-Lösung |
| 7.1.3.1 Im neutralen Milieu | |
| Durchführung: | Die Cobaltchlorid-Lösung wird hergestellt, indem 11,90g CoCl2·6H20 in einen 100ml-Analysenkolben gegeben werden und mit demineralisiertem Wasser bis zur Marke aufgefüllt wird. 10,0ml der roten Lösung werden verwendet und mit den unterschiedlichen Metallen versetzt.
|
| Beobachtungen: |
|
| Ergebnis: |
|
| 7.1.3.2 Im sauren Milieu | |
| Durchführung: | Zu 10,0ml Cobaltchlorid-Lösung wird jeweils 1ml konzentrierte Salpetersäure pipettiert.
|
| Beobachtungen: |
|
| Ergebnis: |
|
| 7.1.3.3 Im alkalischen Milieu | |
| Durchführung: | 10,0ml CoCl2- Lösung werden mit dem jeweiligen Metall und sofort danach mit 1ml 10M Natronlauge versetzt.
|
| Beobachtungen: |
|
| Erklärung: | Es entsteht überall neben Cobalthydroxid, auch Cobalt, welches sich abscheidet. Cobalt ist ebenfalls in Säure löslich und ist daher nach einiger Zeit nicht mehr zu erkennen. |
Fazit:
Trotz der Tatsache, dass alle EMK-Werte positiv waren, sind nicht alle Reaktionen abgelaufen. Dies ist wahrscheinlich ein Grund warum die verwendeten Metalle und Metall-Ionen-Lösungen eher selten verwendet werden. Einzig die Reaktion der Bleinitrat-Lösung mit dem Zink wäre zu Anschauungszwecken geeignet. Alle anderen Reaktion verlaufen zu schwach oder es entstehen Stickoxide oder Hydroxidniederschläge, die die Anschauung erschweren.
Durch vorheriges Anätzen der Eisennägel und der Aluminiumbleche mit Säure oder Aufrauen der Oberfläche mit Schleifpapier hätten eventuell bessere Resultate erzielt werden können.
| 7-2. Abgeschiedene Metallmasse in Abhängigkeit von Zeit und Konzentration | zum Seitenanfang  |
Mit diesem Versuch wollten wir die Abhängigkeit zwischen abgeschiedener Masse an Metall, Zeitdauer und Konzentration der Metall-Ionen-Lösung zeigen. Dazu wählten wir die häufig verwendete Kombination aus Kupfersulfat-Lösung und Eisennägeln.
Kupfer-Ionen werden zu Kupfer reduziert und scheiden sich auf dem Eisennagel als roter Niederschlag ab:
![]()
Eisen wird oxidiert und geht als Fe2+-Ionen in Lösung:
![]()
![]()
Unserer Vermutung nach scheidet sich mit höherer Konzentration und andauernder Zeit eine immer größere Masse an Kupfer ab, bis sich diese Masse einer Grenze immer weiter annähert. Anfangs scheidet sich mehr Kupfer ab, als später. Es kann nicht eine unendlich Menge an Kupfer abgeschieden werden, da irgendwann die gesamte Oberfläche des Eisennagels belegt ist und sich ein chemisches Gleichgewicht einstellt.
Ablauf der Versuchsreihe:
Zunächst wird eine Kupfersulfat-Maßlösung mit der Konzentration c (Cu2+)≈1 mol·L-1 hergestellt. Dazu werden ca. 249,7g CuSO4·5H2O in einen 1L-Kolben eingewogen und mit demineralisiertem Wasser aufgefüllt.
Zur genauen Konzentrationsbestimmung wird der Titer der Maßlösung eingestellt:
Ein Teil der Maßlösung wird genau verdünnt auf die Konzentration c (Cu2+)» 0,1 mol·L-1. Dazu wird 1,00ml mit der Bürette abgemessen und in einen Analysenkolben gegeben. Hiervon werden Viertelsproben entnommen, mit 5ml konzentrierter Schwefelsäure versetzt und im Erlenmeyer auf 50ml mit demin. Wasser aufgefüllt. Anschließend werden 2g Kaliumrhodanid und 0,2g Kaliumiodid hinzugegeben und sofort mit einer Natriumthiosulfat - Maßlösung, c (Na2S2O3) = 0,1 mol·L-1, titriert. Kurz vor dem Erreichen des Äquivalenzpunktes wird 1ml Stärke (w = 0,01) hinzugegeben. Der Äquivalenzpunkt ist erreicht wenn die Lösung sich nahezu entfärbt hat.
Messwerte:
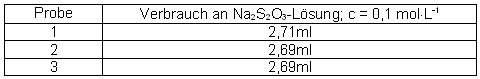
Mittelwert 2,70mlRechnung: 2,70ml · 6,3546mg·ml-1 · 4 = 68,6mg Cu2+
⇒ enthält die Lösung praktisch an Kupfer-Ionen
Theoretisch enthält die Lösung 63,5mg Cu2+-Ionen
t = praktischer Gehalt ÷ theoretischer G.
= 68,6mg ÷ 63,5mg = 1,0803Ergebnis: Die Kupfersulfat Maßlösung hat einen Titer von 1,0803.
Aus der Maßlösung wird nun eine Verdünnungsreihe mit folgenden Konzentrationen erstellt: c (Cu2+) = 0,75 / 0,50 / 0,25 / 0,1 / 0,01 mol·L-1.
Für die Versuchsreihe werden Eisennägel in verdünnter Salzsäure für 5-10 Minuten angeätzt, mit demin. Wasser und anschließend Aceton abgespült und getrocknet. Dann werden sie genau in Reagenzgläser eingewogen, die mit jeweils 2,0ml der jeweiligen Konzentration gefüllt sind und für eine vorbestimmten Zeitraum, zunächst 1 Woche, bei konstanter Temperatur aufbewahrt.
Bereits nach wenigen Minuten stellten wir fest, dass große Teile des abgeschiedenen Kupfers sich bereits von den Nägeln löste und auf den Grund des Reagenzglases fiel. So konnte natürlich keine genaue Wägung der abgeschiedenen Masse nach Ablauf der Zeit vorgenommen werden. Daher begannen wir noch einmal von vorne und änderten die Vorbehandlung der Eisennägel.
Dieses Mal wurden die Nägel für kurze Zeit mit konzentrierter Salzsäure angeätzt, mit demin. Wasser abgespült getrocknet und anschließend mit grobem Schleifpapier bearbeitet. So sollte die Oberfläche der Nägel angeraut werden, damit das abgeschiedene Kupfer besser haften konnte und eine größere Oberfläche vorlag. Das Volumen der Kupfersulfat-Lösung im Reagenzglas wurde auf 2,5ml erhöht, damit gewährleistet ist, dass die Nägel vollständig mit Lösung bedeckt sind.
Jedoch scheiterte auch dieser Versuch. Die Nägel rosteten in der Lösung und der Kupferniederschlag haftete nicht vollständig an den Nägeln. Eine genaue Auswertung wäre wieder nicht möglich gewesen. So änderten wir die Versuchsdurchführung erneut. Zu 2,5ml der Lösung wurden zusätzlich noch einige Tropfen konzentrierte Schwefelsäure gegeben. Der Reagenzglasständer wurde außerdem zur Verlangsamung der Reaktion in ein Eisbad gestellt.
Dieser 3. Versuch blieb ebenfalls erfolglos. Die abgeschiedene Menge an Kupfer war immer noch zu groß, um vollständig auf den Nägeln zu bleiben.
Beim nächsten Versuch blieb die Versuchdurchführung vom 3. Versuch bestehen. Nur die Oberfläche wurde vergrößert, indem statt einem Nagel zwei Nägel pro Reagenzglas eingewogen wurden.
Die Verdopplung der Oberfläche reichte allerdings nicht aus. Wieder fiel ein Teil des abgeschiedenen Kupfer bereits nach kurzer Zeit von den Nägeln ab.
Aufgrund der fortschreitenden Zeit hatten wir nicht mehr die Möglichkeit unsere Versuchsreihe weiter bis zur Funktion zu optimieren. Nach der Entnahme der Nägel aus den Lösungen hätten diese geglüht werden müssen, damit sich das Kupfer vollständig zu Kupfer-(II)-oxid umsetzt. Anschließend hätte man die Nägel wiegen können und anhand der Gewichtszunahme ein Diagramm erstellen können.
Unsere Bemühung waren dennoch nicht umsonst. Wir konnten zwar keine exakten Werte ermitteln, aber aus den optischen Eindrücken lassen sich doch einige Rückschlüsse ziehen.
Anfangs scheidet sich wirklich schnell eine große Menge Kupfer ab. Bei den niederen Konzentrationen, c(Cu2+) = 0,01 -0,1 mol·L-1, scheidet sich weniger Kupfer ab, als bei den höheren Konzentrationen.
Entgegen unserer Vermutung scheidet sich nicht am meisten Kupfer bei der höchsten Konzentration (c(Cu2+) = 1 mol·L-1) ab, sondern bei den mittleren Konzentrationen, c(Cu2+) = 0,75 - 0,25 mol·L-1. Dies liegt an der Aktivität der Ionen, die bei der hohen Konzentration sehr gering ist. Die Cu2+- Ionen stehen sich gegenseitig im Weg.
Den abnehmenden Kupfergehalt in den Lösungen kann man an der langsamen Entfärbung erkennen.

Reagenzgläser mit verschiedenen Konzentrationen von links nach rechts absteigend (1 - 0,01 mol·L-1)
| 7-3. Amalgamierung | zum Seitenanfang  |
Zur Amalgamierung haben wir aufgrund der hohen Umweltschädlichkeit und Giftigkeit des Quecksilbers nur einen Versuch durchgeführt.
Es wurde untersucht ob sich Quecksilber besser in einer neutralen oder angesäuerten Lösung aus einer Salzlösung auf einem Metall abscheidet.
Reaktionsgleichungen:
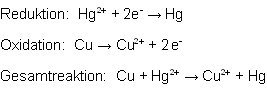
| Durchführung: | Es wurde eine sehr geringes Volumen an Quecksilber-(II)-chlorid-Lösung (w = 0,01) hergestellt. Dazu wurde 0,1g HgCl2 in ein Wägegläschen eingewogen und mit 9,9ml demineralisiertem Wasser versetzt. Die Lösung wurde auf 2 Wägegläschen aufgeteilt. Dann wurde eine Lösung mit 1M Schwefelsäure angesäuert, der anderen wird vorerst nichts zugesetzt. Anschließend wurde zu beiden ein Kupferblech gegeben. |
| Beobachtungen: |
In der angesäuerten Lösung scheidet sich sofort Quecksilber ab, während in der unangesäuerten Lösung keine Veränderung zu beobachten ist. Der Niederschlag verstärkt sich mit der Zeit und die Lösung färbt sich blau.
|
| Ergebnis: | Durch die unterschiedlichen Normalpotentiale scheidet sich das edlere Quecksilber auf dem Kupfer ab. Die Lösung wird mit der Zeit blau, da Cu2+- Ionen in Lösung gehen. |
Derselbe Versuch wurde dann auch noch mit Eisennägeln statt Kupferblechen durchgeführt.
| Beobachtungen: | Im Gegensatz zum Kupferblech scheidet sich sowohl bei der angesäuerten, als auch bei der unangesäuerten Lösung Quecksilber auf dem Nagel ab. |
| Ergebnis: | Auf dem unedleren Eisennagel scheidet sich in beiden Fällen Quecksilber ab. Fe2+- Ionen gehen in Lösung. |
| Diskussion: | Eisen und Quecksilber stehen in der Spannungsreihe weiter auseinander als Kupfer und Quecksilber. Die Amalgambildung funktioniert beim Eisen besser, bei Kupfer muss die Lösung erst angesäuert werden. |
| 7-4. Aufarbeitung der Abfälle im Labor | zum Seitenanfang  |
Da im Rahmen der Versuche mit giftigen Quecksilberverbindungen gearbeitet wurde, war es nötig die Abfälle ordnungsgemäß aufzuarbeiten, damit sie nicht in die Umwelt gelangen oder anderweitig Schaden verursachen.
Die Abfälle aus den Versuchen mit Nickel, Cobalt, Kupfer, Eisen und Blei wurden in einem Behälter gesammelt, während die quecksilberhaltigen Lösungen separat gesammelt wurden.
Die Schwermetalle wurden durch Zugabe von Natriumhydroxid bis zu einem stark alkalischen pH-Wert als Hydroxide gefällt, anschließend filtriert, getrocknet und an die Laborassistenten übergeben.
Reaktionsgleichung für die Fällung von Eisen:
![]()
Analog gelten die Reaktionsgleichungen für die anderen Metalle.
Die Quecksilberabfälle wurden mit 2 M Salzsäure angesäuert und mit Zinkpulver zum Element reduziert. Das entstandene elementare Quecksilber wurde in einen speziellen Behälter für derartige Abfälle gegeben.
Die Reaktionsgleichung lautet:
![]()

Das Quecksilber wird abfiltriert, bevor es entsorgt wird
| 8. Weltkulturerbetag im Kloster Maulbronn - Die Alchemie des Doktor Faustus | zum Seitenanfang  |
Am 7. Juni 2009 fand eine Veranstaltung zum Weltkulturerbetag im Zisterzienserkloster in Maulbronn statt.
Das Kloster Maulbronn hat eine lange Geschichte. Es wurde 1147 von Zisterzienser-Mönchen gegründet und auf vom Bischof von Speyer gestifteten Boden errichten. Im Jahr 1178 ist das Kloster vom Bischof von Trier geweiht worden . Im 14. Jahrhundert hatten die Grafen von Württemberg die Schirmvogtei des Klosters inne, 1504 jedoch eroberte es Herzog Ulrich von Württemberg und führte 1534 die Reformation ein. 1556 wurde Maulbronn von Herzog Christoph in eine evangelische Klosterschule umgewandelt.
Johann Entenfuß, der von 1512 bis 1518 Abt des Klosters war, holte schließlich Faust nach Maulbronn, damit dieser dem Abt Gold herstellen sollte und die Geldprobleme, in die der Abt das Kloster durch seine Bauvorhaben brachte, beendete. Faust war im Jahre 1516 im Kloster tätig und daran erinnern heute noch der Faustturm, das Faustloch und die Faustküche.
Dies nahm sich das Institut Dr. Flad als Vorlage um ebenfalls einen Beitrag zu dem großen Rahmenprogramm am 7. Juni zu leisten. Also haben wir, Kerstin Wiedmann, Lana Mohamed, Felix Schlecht und Dirk Göllner, an einem Stand aus dreihundert Pfennigmünzen "Gold" hergestellt (s. Versuch 8.8).

Der Stand auf dem Klosterhof
Diese Vorführung war auch Höhepunkt des Vortrages, der am Nachmittag von Prof. Dr. Georg Schwedt über die "Alchimistenküche des Doktor Faustus" gehalten wurde. Wir vier Schüler*innen vom Institut Dr. Flad dienten ihm dabei als "Adepten" und führten begleitend zu seinem Vortrag veranschaulichende Versuche vor:
| 8.1 Transmutation | |
| Benötigte Chemikalien: | Kupfersulfat-Pentahydrat, demineralisiertes Wasser und Eisennägel |
| Versuch: | Wir lösen soviel Kupfervitriol im Wasser auf, bis die Lösung eine deutlich blaue Färbung aufweist. Dann wird ein Eisennagel in die Lösung gegeben (ein Ende sollte noch heraus schauen) und gewartet, bis sich eine dunkle Schicht Kupfer darauf abscheidet. |
| Auswertung: | Da Kupfer ein edleres Metall ist als Eisen und somit ein höheres Standardpotential besitzt, wird es in einer Redox-Reaktion zu elementarem Kupfer reduziert und Eisen zu Eisen-(II) oxidiert. Das entstandene Kupfer scheidet sich am Nagel ab. Hat man ein Stück des Eisennagels aus der Lösung stehen lassen, so lässt sich umso deutlicher erkennen, dass der Nagel verkupfert wurde. |
| 8.2.Sublimation | |
| Benötigte Chemikalien und Geräte: | Schwefel, Reagenzglas (Mikro), Reagenzglasklammer und Brenner |
| Versuch: | Wir geben etwas vom elementaren Schwefel ins Reagenzglas und erhitzen bis der Schwefel schmilzt und verdampft. |
| Auswertung: | Durch die Enantiotropie des Schwefels wandelt sich dieser in der Brennerhitze in verschiedene Modifikationen (Alpha-, Beta-Schwefel) um. Dies ruft einen Farbwechsel während dem erhitzen vor. Der verdampfte Schwefel setzt sich am oberen Rand des Reagenzglases wieder ab und überspringt dabei die flüssige Phase (Sublimation). |
| 8.3 Brennlichkeit von Schwefel | |
| Benötigte Chemikalien und Geräte: | Schwefel, Ceran-Platte, Brenner |
| Versuch: | Wir geben etwas Schwefel auf die Ceran-Platte und zünden es mit dem Brenner an. |
| Auswertung: | Der Schwefel verbrennt in einer bläulichen Flamme. Der Schwefel brennt, weil es so zu Schwefeldioxid oxidiert werden kann. S + O2 → SO2 |
| 8.4 Sublimation von Quecksilber | |
| Benötigte Chemikalien und Geräte: | Quecksilber-(II)oxid, Brenner, Reagenzglas (Mikro) und Aktivkohlefilter |
| Versuch: | Wir geben das Quecksilbersalz ins Reagenzglas und verschließen es mit dem Aktivkohlefilter. Dann wird das Glas vorsichtig über der Flamme erhitzt bis sich am oberen Rand des Glases metallisches Quecksilber absetzt. |
| Auswertung: | Aufgrund des hohen Dampfdrucks des Quecksilbers verdampft es schnell in der Wärme. Am oberen, kalten Rand des Reagenzglases sublimiert das Quecksilber wieder. Dies lässt sich an einer silbrigen Schicht am Glas erkennen. |
| 8.5 Amalgamierung | |
| Benötigte Chemikalien und Geräte: | Quecksilber-(II)chlorid, demineralisiertes Wasser, Kupfermünze, Essigsäure |
| Versuch: | Es wird so viel des Quecksilbersalzes im Wasser gelöst, bis man eine 1%ige Lösung erhält. Diese wird noch mit einigen Tropfen Essigsäure angesäuert und die Kupfermünze hineingegeben. Es lässt sich Verfärbung der Münze beobachten. |
| Auswertung: | Wie in Versuch Nr. 1 wird in einer Redox-Reaktion Kupfer von der Münze oxidiert und Quecksilber reduziert. Das entstandene elementare Quecksilber scheidet sich auf der Münze ab, wodurch diese eine dunkle Färbung erhält. |
| 8.6 Farbindikator | |
| Benötigte Chemikalien und Geräte: | Rotkohl, demineralisiertes Wasser, Essigsäure, Natriumcarbonat (Soda), Bechergläser |
| Versuch: | Der Rotkohl wird für ca. 10 Minuten in Wasser gekocht und die erhaltene Lösung (Indikator) von den Feststoffen befreit. Es wird nun in drei verschiedene Bechergläser Indikator gegeben und je einer mit Essigsäure und Soda versetzt. Das dritte Becherglas enthält nur den Indikator. |
| Auswertung: | Durch Zugabe von Soda oder Essigsäure wird der pH-Wert ins Alkalische oder Saure geschoben. Dadurch erkennt man einen Farbwechsel der Indikatorlösung. Im Sauren besitzt sie eine rote Farbe, im Neutralen ist sie blau und im Alkalischen grün. Somit haben wir einen Farbindikator aus Rotkohlsaft hergestellt. |
| 8.7 Schwarzpulver | |
| Benötigte Chemikalien und Geräte: | Schwefel, Kaliumnitrat (Salpeter), Kohle, Mörser und Pistill, Keramikplatte, Glimmspan |
| Versuch: | Der Schwefel wird mit Salpeter und der Kohle in einem Mörser fein verrieben und gut durchgemischt. Das so entstandene Schwarzpulver wird in einer dünnen Spur auf der Keramikplatte verteilt und mir einem Glimmspan entzündet. Es verpufft in einer großen Wolke. |
| Auswertung: | In der Schwarzpulvermischung funktioniert der Salpeter als Sauerstofflieferant um den Kohlenstoff und den Schwefel zu oxidieren. Es entstehen die Gase Kohlenstoffdioxid und Schwefeldioxid, die eine rasche Volumenexpansion hervorrufen. Dies wirkt in einem geschlossenen System explosiv, haben die Gase jedoch genug Platz um sich ungestört auszubreiten, erfolgt lediglich eine Verpuffung ohne nennenswerte Explosion. |
| 8.8 Goldherstellung | |
| Benötigte Chemikalien und Geräte: | 10 M Natronlauge, Zink, Kupferpfennige, Bechergläser, Tiegelzange und Brenner |
| Versuch: | In 10 M Natronlauge werden einige Spatelspitzen Zinkpulver gegeben und die Suspension kurz erhitzt. Danach wird ein zuvor mit Schleifpapier gereinigte Kupfermünze in die Suspension gebracht und erneut kurz gekocht. Nach kurzer Zeit hat die Münze eine silberne Farbe erhalten und wird mit der Zange aus der Suspension geholt. Nach erneuter, sanfter Reinigung mit Wasser und einem Zellstofftuch wird die Münze mit der Tiegelzange in die Brennerflamme gehalten bis sich die silberne Farbe in eine Goldene ändert. |
| Auswertung: | Das Zinkpulver löst sich größtenteils in der Natronlauge, wodurch sich ein Zinkatkomplex und Wasserstoff bildet. Das im Komplex gelöste Zink scheidet sich anschließend auf der Kupfermünze ab, was ihr eine silberne Farbe verleiht. Durch das Erhitzen in der Brennerflamme bildet sich bei diesen hohen Temperaturen aus dem oberflächlich abgeschiedenen Zink und dem Kupfer eine Messinglegierung. Diese besitzt eine goldene Farbe. Wir haben also kein echtes Gold hergestellt, sondern lediglich eine Münze mit einer goldenen Farbe überzogen. Im zeitlichen Kontext der Alchimisten jedoch bedeutete Transmutation nicht nur die reale Umwandlung eines Stoffes in den Anderen, sondern auch eine oberflächliche Änderung der Erscheinung. Somit haben wir nach der damaligen Sicht "Gold" hergestellt. |
Natürlich ging dem Auftritt in Maulbronn eine lange Vorbereitungszeit voraus. So haben wir öfters miteinander, mit Wolfgang und Jürgen Flad und Prof. Dr. Schwedt die Versuche ausprobiert und optimiert. Alle Chemikalien wurden von uns schon im Voraus angesetzt, damit sie vor Ort sofort verfügbar waren und wir in Maulbronn keine Zeit verschwenden mussten mit dem Ansetzen einer neuen Lauge etc.
Insgesamt kann man den Weltkulturerbetag in Maulbronn als vollen Erfolg betrachten, da wir vier nicht nur am Stand einen sehr großen Besucherandrang hatten (er war der bestbesuchte Stand nach den Imbissständen!), sondern bei der Vorführung mit Prof. Dr. Schwedt, trotz unseres Debuts als Schausteller, ein Publikum von über einhundert Zuschauern mitreißen konnten.
 Die vier "Adepten" mit Prof. Dr. Schwedt |
 Ein großes Publikum verfolgte den Vortrag |
| 9. Chemikalienkatalog | zum Seitenanfang  |
Hier eine Auflistung der für die Projektarbeit verwendeten Chemikalien sowie der Gefahrstoffkennzeichnungen und R/S-Sätze:
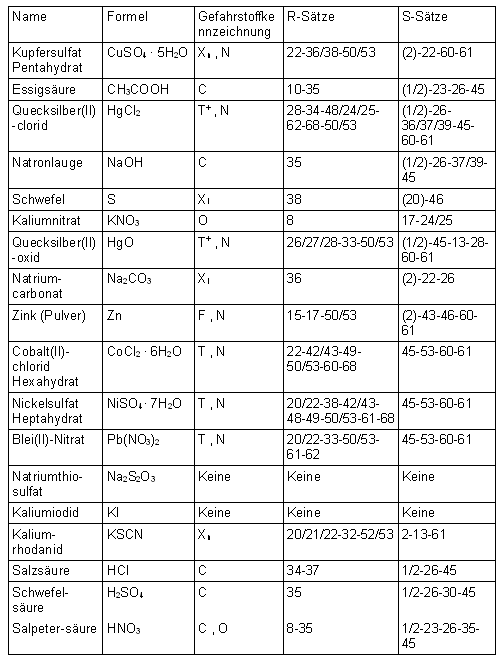
| 9.1 Gefahrstoffkennzeichnungen | |
| Xn | Gesundheitsschädlich |
| Xi | Reizend |
| N | Umweltgefährlich |
| C | Ätzend |
| F | Leichtentzündlich |
| T | Giftig |
| T+ | Sehr giftig |
| O | Brandfördernd |
| 9.2 R-Sätze | |
| R 8 | Feuergefährlich bei Berührung mit brennbaren Stoffen |
| R 10 | Entzündlich |
| R 11 | Leichtentzündlich |
| R 15 | Reagiert mit Wasser unter Bildung leichtentzündlicher Gase |
| R 17 | Selbstentzündlich an der Luft |
| R 20 | Gesundheitsschädlich beim Einatmen |
| R 21 | Gesundheitsschädlich bei Berührung mit der Haut |
| R 22 | Gesundheitsschädlich beim Verschlucken |
| R 24 | Giftig bei Berührung mit der Haut |
| R 25 | Giftig beim Verschlucken |
| R 26 | Sehr giftig beim Einatmen |
| R 27 | Sehr giftig bei Berührung mit der Haut |
| R 28 | Sehr giftig beim Verschlucken |
| R 32 | Entwickelt bei Berührung mit Säure sehr giftige Gase |
| R 33 | Gefahr kumulativer Wirkungen |
| R 34 | Verursacht Verätzungen |
| R 35 | Verursacht schwere Verätzungen |
| R 36 | Reizt die Augen |
| R 37 | Entwickelt bei Berührung mir Säure sehr giftige Gase |
| R 38 | Reizt die Haut |
| R 42 | Sensibilisierung durch Einatmen möglich |
| R 43 | Sensibilisierung durch Hautkontakt möglich |
| R 48 | Gefahr ernster Gesundheitsschäden bei längerer Exposition |
| R 49 | Kann Krebs erzeugen beim Einatmen |
| R 50 | Sehr giftig für Wasserorganismen |
| R 52 | Schädlich für Wasserorganismen |
| R 53 | Kann in Gewässern längerfristige schädliche Wirkung haben |
| R 61 | Kann das Kind im Mutterleib schädigen |
| R 62 | Kann möglicherweise die Fortpflanzungsfähigkeit beeinträchtigen |
| R 60 | Kann die Fortpflanzungsfähigkeit schädigen |
| R 68 | Irreversibler Schaden möglich |
| 9.3 S-Sätze | |
| S 1 | Unter Verschluss aufbewahren |
| S 2 | Darf nicht in die Hände von Kindern gelangen |
| S 13 | Von Nahrungsmitteln, Getränken und Futtermitteln fernhalten |
| S 17 | Von brennbaren Stoffen fernhalten |
| S 20 | Bei der Arbeit nicht essen und trinken |
| S 22 | Staub nicht einatmen |
| S 23 | Gas/Dampf/Rauch/Aerosol nicht einatmen (vom Hersteller anzugeben) |
| S 24 | Berührung mit der Haut vermeiden |
| S 25 | Berührung mit den Augen vermeiden |
| S 26 | Bei Berührung mit den Augen gründlich mit Wasser abspülen und Arzt konsultieren |
| S 28 | Bei Berührung mit der Haut sofort abwaschen mit viel... (vom Hersteller anzugeben) |
| S 35 | Abfälle und Behälter müssen in gesicherter Weise beseitigt werden |
| S 36 | Bei der Arbeit geeignete Schutzkleidung tragen |
| S 37 | Geeignete Schutzhandschuhe tragen |
| S 39 | Schutzbrille/Gesichtsschutz tragen |
| S 43 | Zum Löschen... (vom Hersteller anzugeben) verwenden (wenn Wasser die Gefahr erhöht, anfügen: Kein Wasser verwenden) |
| S 45 | Bei Unfall oder Unwohlsein sofort Arzt hinzuziehen |
| S 46 | Bei Verschlucken sofort ärztlichen Rat einholen und Verpackung oder Etikett vorzeigen |
| S 53 | Exposition vermeiden - vor Gebrauch besondere Anweisungen einholen |
| S 60 | Dieser Stoff und sein Behälter sind als gefährlicher Abfall zu entsorgen |
| S 61 | Freisetzung in die Umwelt zu Vermeiden. Besondere Anweisungen einholen / Sicherheitsdatenblatt zu Rate ziehen |
Quelle: praktikum.de/de/articles/pdf/RSPhrases_de.pdf (06.02.2010)
| 10. Schlusswort | zum Seitenanfang  |
Obwohl alle Versuche in der Theorie funktionieren sollten, waren die Ergebnisse doch unbefriedigend. Bis auf den Versuch mit Bleinitrat und Zink haben alle anderen entweder gar nicht oder nur mit bescheidenem Erfolg funktioniert. Hier wären sicherlich noch Optimierungen der Reaktionsbedingungen nötig gewesen, die jedoch aus zeitlichen Gründen nicht erfolgen konnten.
Nichtsdestotrotz ist das Thema Transmutation und Amalgamierung ein sehr interessantes und wichtiges Thema und bietet darüber hinaus noch Potential für Schausteller, wie wir in Maulbronn bewiesen haben.
| 11. Literaturverzeichnis | zum Seitenanfang  |
« zurück zur Übersicht - Projektarbeiten



