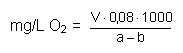|
Die Bestimmung eines Chemischen Indexes zur Ermittlung der Gewässergüteklasse von Fließgewässern |
Bestimmung des Sauerstoffs und der Sauerstoffsättigung (Methode nach Winkler)
| Geräte: | 1 Glasflasche ca. 110-130 mL mit abgeschrägtem Glasstopfen (Winklerflasche) 1 Pipette 1 mL 1 Pipette zum Absaugen des Wassers Geräte für die Titration |
||||||
| Reagenzien: | ortho-Phosphorsäure 85 %ig Natriumthiosulfatlösung 0,01 mol/L: 2,482 g Natriumthiosulfat Pentahydrat werden mit demin. Wasser in 1000 mL gelöst Zinkiodid/Stärke-Lösung: fertig zu beziehen (z. B. bei Merck, Art. 5445) |
||||||
| Durchführung: | Eine Winklerflasche wird mit Untersuchungswasser zu etwa 2/3 gefüllt und mit jeweils 1 mL Mangan(II)-chloridlösung und kaliumiodidhaltiger Natronlauge (siehe BSB-Bestimmung) versetzt. Anschließend wird die Flasche luftblasenfrei mit Untersuchungswasser aufgefüllt, fest verschlossen und gut geschüttelt. Nachdem sich der entstandene Niederschlag abgesetzt hat, wird die überstehende klare Lösung vorsichtig abgesaugt (ohne den Niederschlag aufzuwirbeln). Der in der Flasche verbliebene Niederschlag wird anschließend mit 2 mL Phosphorsäure gelöst, die Flasche verschlossen und für ca. 10 Minuten im Dunkeln aufbewahrt. Das in der Lösung freigesetzte Iod wird mit Natriumtriosulfat-Lösung titriert, bis sie eine hellgelbe Farbe angenommen hat. Dann setzt man 1 mL Zinkiodid/Stärke-Lösung zu und titriert die Probe bis zu Entfärbung weiter. | ||||||
| Auswertung: |
Mit 1 mL der verwendeten Natriumthiosulfatlösung (0,01 mol/L) werden 0,08 mg Sauerstoff erfasst.
Hierin bedeuten:
|
Die Sauerstoffsättigung wird als prozentualer Anteil der bei den gegebenen Bedingungen (Temperatur und Luftdruck) maximal lösbaren Menge Sauerstoff (= 100 % Sättigung) angegeben. Diese Sättigungsmengen können nachfolgender Tabelle entnommen werden.
Tabelle zur Ermittlung der Sauerstoffsättigung (Auszug)
Ermittlung der Sauerstoffsättigung in Abhängigkeit von der Temperatur bei einem Gesamtdruck der wasserdampfgesättigten Atmosphäre von 760 Torr nach Truesdale, Downing und Lowden - J. Appl. Chem. 5 (1955). 53
| 0 | 14.16 | 10 | 10.92 | 20 | 8.84 | 30 | 7,53 |
| 1 | 13,77 | 11 | 10.67 | 21 | 8.68 | 31 | 7.42 |
| 2 | 13.40 | 12 | 10.43 | 22 | 8.53 | 32 | 7.32 |
| 3 | 13.05 | 13 | 10.20 | 23 | 8.38 | 33 | 7.22 |
| 4 | 12.70 | 14 | 9.98 | 24 | 8.25 | 34 | 7.13 |
| 5 | 12.37 | 15 | 9.76 | 25 | 8.11 | 35 | 7,04 |
| 6 | 12.06 | 16 | 9.56 | 26 | 7.99 | 36 | 6.94 |
| 7 | 11,76 | 17 | 9.37 | 27 | 7,86 | 37 | 6.86 |
| 8 | 11,47 | 18 | 9.18 | 28 | 7.75 | 38 | 6.76 |
| 9 | 11.19 | 19 | 9.01 | 29 | 7.64 | 39 | 6.68 |
| 10 | 10.92 | 20 | 8.84 | 30 | 7.53 | 40 | 6,59 |
Beispiel:
| Gemessene Wassertemperatur | 13°C | |||
| Sauerstoff-Sättigungswert nach Tabelle: | 10,2 | mg/L | = | 100% |
| Gemessene Sauerstoffkonzentration: | 9,1 | mg/L | = | 89% |
Da der Luftdruck normalerweise nicht zu stark vom Normaldruck abweicht, kann dieser in erster Näherung vernachlässigt werden.
| << zurück | weiter >> | |
| Entnahme und Messungen vor Ort | Bestimmung des Biochemischen Sauerstoffbedarfs (BSB) |
![]()
Kompletter Beitrag "Chemischer Index und Gewässergüte" in PDF